- Gicht im Wandel der Zeiten: von der Krankheit der Könige zur Hyperurikämie als Organ-Risikofaktor
Gicht
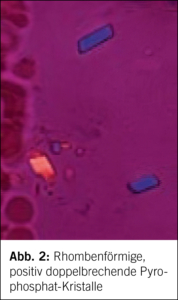
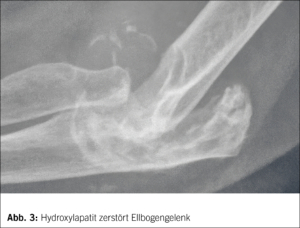
Das vorliegende Heft der Therapeutischen Umschau widmet sich einer der ältesten und nach wie vor hochaktuellen rheumatologischen Krankheit, der Gicht. Schuld an den Schmerzen haben die im Polarisationsmikroskop wunderschönen, nadelförmigen, negativ doppelbrechenden Uratkristalle (Abb. 1), und ein Gichtanfall sowie die chronische Gicht gehören zum Praxisalltag (siehe erster Artikel im Heft). Selbstverständlich schliessen wir dabei auch die weiteren Kristallarthropathien (siehe zweiter Artikel im Heft), insbesondere die Chondrocalcinose (Calciumpyrophosphat Erkrankung, CPPD) mit ihren charakteristischen, rhombenförmigen, positiv doppelbrechenden CPPD-Kristallen (Abb. 2), aber auch die Hydroxylapatiterkrankung mit vorwiegend periartikulärer Ablagerung von Basiskalziumphosphaten (Abb. 3), mit ein. Die Gicht-Forschung der letzten Jahre hat, nach einem längeren Maurerblümchendasein mit bekanntem Gicht-Stoffwechsel und Allopurinol-Therapie, wichtige neue Bildgebung und Therapiemodalitäten entwickelt, und die Bedeutung einer (asymptomatischen) Hyperurikämie wird ebenso von Nephrologen, Kardiologen und Neurologen diskutiert.
Historie
Die Gicht war seit der Antike das Vorzeigemodell der rheumatologischen Erkrankungen und steht im 19. Jahrhundert am Anfang des Fachgebietes der Rheumatologie. So schrieb Hippokrates (460–377 v. Chr.): «Bei der Arthritis dauert das Fieber an, ein stechender Schmerz ergreift die Gelenke des Körpers, und die Schmerzen – bald heftiger, bald weniger stark – befallen bald das eine Gelenk, bald das andere». Im Briefwechsel schreibt Erasmus von Rotterdam (1469–1536) an Thomas Morus (1478–1535): «Du hast Nierensteine, und ich habe die Gicht: wir haben zwei Schwestern geheiratet». Johann Fischart schrieb 1577 für die Schmerzgeplagten ein «Podagrammisches Trostbüchlein», und ein mittelalterlicher Vierzeiler lautete: «Vinum der Vater / Coena die Mutter / Venus die Hebamm’ / machen das Podagram». Karl Wilhelm Scheele entdeckte 1776 die Harnsäure in Harnsteinen, und Alfred B. Garrod führte 1848 den Fadentest (Zuckerbonbon an einer Schnur) in die Sprechstunde ein. Als Zitat aus dem 19. Jahrhundert führe ich gern noch Wilhelm Busch (1832–1908) an: «Der Handwerksbursche, froh und frei, / ruht sanft im duft’gen Wiesenheu. / Der Dicke aber, autsch mein Bein! / hat wieder heut’ das Zipperlein.»
Was kommt nach der Geschichte?
Die Zeiten mögen sich geändert haben, aber die alten Weisheiten haben nach wie vor einen Stellenwert. Nur wissen wir heute, dass neben der Adipositas auch der Genetik eine bedeutende Rolle zukommt: Das Potenzial für Ernährung betrug in einer Studie 0.3 %, der Einfluss der Genetik jedoch 23.9 % (1). Diät war früher das erste Stichwort bei der Besprechung der Gicht, und in der Assistenzzeit hatten wir ein Merkblatt «Gicht-Diät» in der Manteltasche – Diät ist heute noch wichtig, aber mehr als Motivationsfaktor beispielsweise für Gewichtsreduktion, Bewegung und regelmässige Medikamenteneinnahme (siehe vierter Artikel im Heft). Zur Diagnostik machen wir kaum noch einen Fadentest, sondern greifen auf Sonografie und Dual Energy-basierte Computertomographie (DECT) und bald auch auf Photonenzähldetektoren (Photon-Counting-CT, PCD-CT) oder Raman-Spektroskopie zurück (siehe letzter Artikel im Heft). Gemäss neuester Empfehlung können die typischen bildgebenden pathognomonischen Zeichen wie die «Doppelkontur» oder eindeutige Tophi im Ultraschall beziehungsweise die positive Farbkodierung (grüne Spots) urathaltiger Weichteilformationen im DECT den früheren Goldstandard (für die Diagnose einer Gicht) des Nachweises von Uratkristallen in der Synovialflüssigkeit überflüssig machen (2). Bei der Anfallstherapie feiert Colchicin trotz seiner Gefährlichkeit als Zellgift eine Wiederbelebung und wird, bei der Gicht ebenso wie bei der CPPD, auch als Anfallsprophylaxe gern eingesetzt (siehe zweiter und dritter Artikel im Heft). Die langfristige Therapie basiert zwar nach wie vor auf den Xanthinoxidase-Hemmern (XOI) wie Allopurinol und neuerdings Febuxostat, aber deren Einsatzgebiet (auch asymptomatische Hyperurikämie?) wird diskutiert, und für schwere Verläufe stehen bald Zytokininhibitoren wie Anakinra, (Rilonacept) und Canakinumab sowie neue XOI (Topiroxostat und Tigulixostat), Pegloticase und SGLT2-Inhibitoren zur Verfügung (siehe vorletzter Artikel im Heft).
Epidemiologie
Gicht ist eine der häufigsten rheumatologischen Erkrankungen mit einer Prävalenz von 3–4 % in der westlichen Bevölkerung (3, 4). Männer sind dreimal so häufig betroffen wie Frauen (5). Die Prävalenz der Gicht ist erschreckend zunehmend, um 30 % in den vergangenen 15 Jahren (6). Die Inzidenz der ersten Gichtattacke korreliert linear mit steigender Serum-Harnsäure (7, 8); auch später besteht eine Dosis-Wirkungs-Beziehung zwischen der Serum-Harnsäure und der Schubhäufigkeit (9). Die Höhe des Serum-Harnsäurewertes bestimmt auch das Auftreten von Tophi (10). Die tophöse Form der Gicht tritt erst nach jahrelang bestehender oder ungenügend behandelter Hyperurikämie auf. Ein wichtiger Gesundheitsfaktor ist die Häufigkeit von Komorbiditäten wie chronische Nierenerkrankung (CKD) und Nierensteine, Übergewicht, Hypertonie, Diabetes mellitus, Hyperlipidämie, erektile Dysfunktion (11), Schlaganfall und Herzinfarkt, welche bei Individuen mit Hyperurikämie beobachtet werden (12, 13, 14) und unbedingt abgeklärt und behandelt werden müssen.
Pathophysiologie
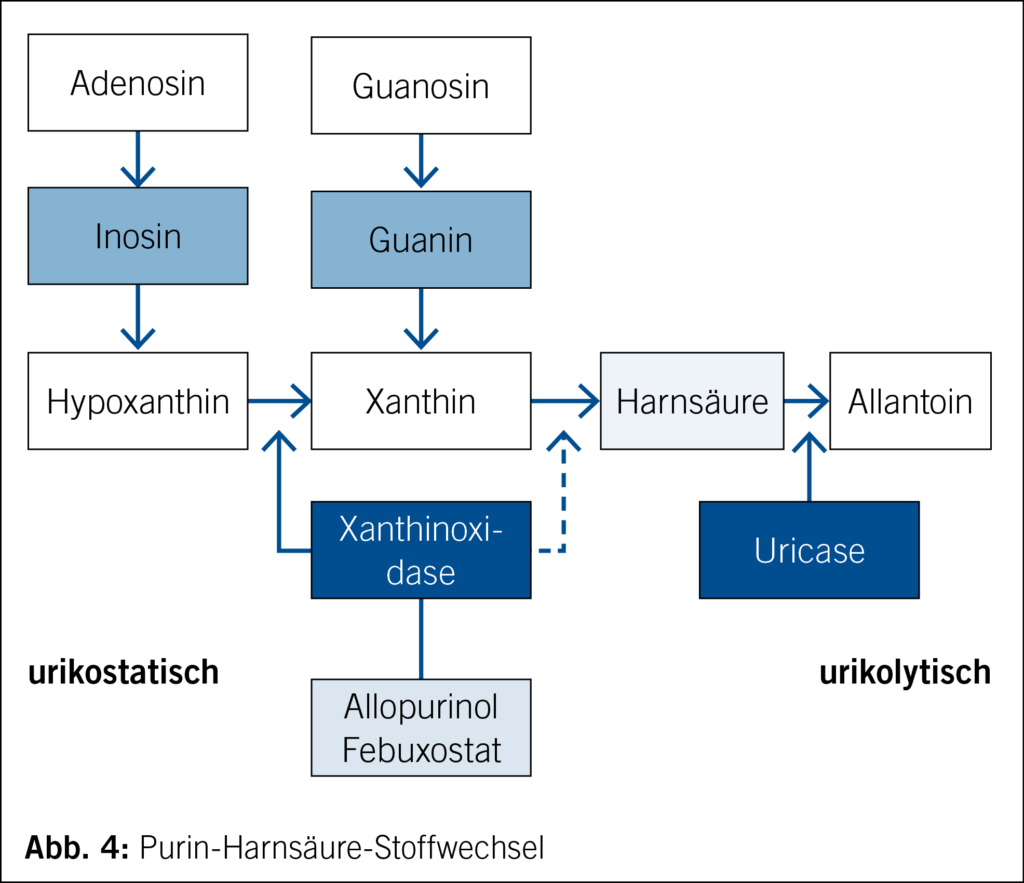
Der Purin-Harnsäure-Stoffwechsel ist bekannt, soll aber zur Erinnerung kurz evoziert werden (Abb. 4). Entscheidend ist vor allem die Löslichkeitsschwelle der Harnsäure im Serum, welche bei einer Konzentration um 400 µmol/L liegt (15); bei höherer Konzentration fällt die Harnsäure in Form von Kristallen aus, bei tieferer können sich Kristalle auflösen. Damit ergibt die Bestimmung der Serum-Harnsäure viel Sinn, und auch wenn wir politisch angeschuldigt werden, zu viele angeblich unnötige Laborwerte und Kosten zu verursachen, wird meines Erachtens der Serum-Harnsäure zu wenig Beachtung geschenkt.
Hyperurikämie
Die gesundheitliche Bedeutung der Hyperurikämie wird, vor allem hinsichtlich neurologischer Wirkung, kontrovers diskutiert. Unbestritten ist der negative Effekt der Hyperurikämie auf die Niere. Für das kardiovaskuläre Gebiet zeigen Studien beispielsweise zu kardiovaskulären Todesfällen (16), zum kardiovaskulären Risiko (17) und zur peripher-arteriellen Verschlusskrankheit (18), dass die Senkung des erhöhten Serumharnsäurewertes einen günstigen Einfluss auf das kardiovaskuläre System hat, und der erhöhte Blutdruck wird mit Normalisierung des erhöhten Serumharnsäurewertes günstig beeinflusst (19); eine neueste Kompilation belegt die günstige kardiovaskuläre Wirkung der Senkung der Hyperurikämie (20). – Ein ungeklärtes Diskussionsgebiet ist der sogenannt neuroprotektive Aspekt der Harnsäure. In einer Studie war das Risiko einer vaskulären oder gemischten Demenz bei niedrigem Serumharnsäurewert grösser (21), was zur Empfehlung geführt hat, die Harnsäure bei älteren Menschen nicht allzu tief zu senken. Jedoch zeigte eine andere Studie keinen Einfluss der Harnsäure auf die Häufigkeit eines Morbus Alzheimer (22). – Die nahe Zukunft wird zeigen, ob die Hyperurikämie einen der
Hypercholesterinämie ähnlichen Stellenwert erhalten wird.
Ihre Leselust für das spannende Gebiet der Gicht und Kristallarthropathien wird mit diesem Heft nicht enttäuscht werden, und dafür danke ich der Autorin und den Autoren der sechs Artikel herzlich.
Chefarzt emeritus Rheumaklinik Triemli
8800 Thalwil
marwebdr@gmail.com
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
1 Major TJ, Topless RK, Dalbeth N, Merriman TR. Evaluation of the diet wide contribution to serum urate levels: meta-analysis of population based cohorts. BMJ. 2018 Oct 10;k3951.
2 Mandl P, D’Agostino MA, Navarro-Compán V, et al. 2023 EULAR recommendations on imaging in diagnosis and management of crystal-induced arthropathies in clinical practice. Ann Rheum Dis. 2024;83(6):752–759. doi: 10.1136/ard-2023-224771.
3 Kuo C-F, Grainge MJ, Mallen C, Zhang W Doherty M. Rising burden of gout in the UK but continuing suboptimal management: a nationwide population study. Ann Rheum Dis 2015 Apr;74(4):661-7.
4 Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008. Arthritis Rheum 2011 Oct;63(10):3136-41.
5 Trifirò G, Morabito P, Cavagna L, Ferrajolo C, Pecchioli S, Simonetti M, et al. Epidemiology of gout and hyperuricaemia in Italy during the years 2005-2009: a nationwide population-based study. Ann Rheum Dis 2013 May;72(5):694-700.
6 Winnard D, Wright C, Taylor WJ, Jackson G, Karu LT, Gow PJ, et al. National prevalence of gout derived from administrative health data in Aotearoa New Zealand. Rheumatology (Oxford) 2012 May;51(5):901-9.
7 Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med 1987;82:421-6.
8 McCormick N, Yokose C, Challener GJ, Joshi AD, Tanikella S, Choi HK. Serum Urate and Recurrent Gout. JAMA 2024;331(5):417-24.
9 Tedeschi SK, Hayashi K, Zhang Y, Choi H, Solomon DH. Identifying the association between serum urate levels and gout flares in patients taking urate-lowering therapy: a post hoc cohort analysis of the CARES trial with consideration of dropout. Ann Rheum Dis 2024 May 8:ard-2024-225761.
10 Gutman AB. The past four decades of progress in the knowledge of gout, with an assessment of the present status (A retrospective analysis of 1165 patients with gout before appropriate drug therapy). Arthritis Rheum 1973;16:431-45.
11 Sultan AA, Mallen C, Hayward R, Muller S, Whittle R, Hotston M, Roddy E. Gout and subsequent erectile dysfunction: a population-based cohort study from England. Arthritis Res Ther 2017 Jun 6;19(1):123.
12 Zhu Y, Pandya BJ, Choi HK. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007-2008. Am J Med 2012;125:679-87.
13 Elfishawi MM, Zleik N, Kvrgic Z, Michet CJ Jr, Crowson CS, Matteson EL, Bongartz T. The Rising Incidence of Gout and the Increasing Burden of Comorbidities: A Population-based Study over 20 Years. J Rheumatol. 2018 Apr;45:574-9.
14 Singh JA. Gout and comorbidity: a nominal group study of people with gout. Arthritis Res Ther 2017;19:204.
15 Hamburger M, Baraf HSB, Adamson TC, Basile J, Bass L, Cole B et al. 2011 Recommendations for the diagnosis and management of gout and hyperuricemia. Postgrad Med 2011 Nov;123(6 Suppl 1):3-36.
16 Kuo C-F, See L-C, Yu K-H, Chou I-J, Chiou M-J, Luo S-F. Significance of serum uric acid levels on the risk of all-cause and cardiovascular mortality. Rheumatology (Oxford) 2013 Jan;52(1):127-34.
17 Larsen KS, Pottegård A, Lindegaard HM, Hallas J. Effect of Allopurinol on Cardiovascular Outcomes in Hyperuricemic Patients: A Cohort Study. Am J Med 2016;129:299-306.
18 Singh JA, Cleveland J. Allopurinol and the risk of incident peripheral arterial disease in the elderly: a US Medicare claims data study. Rheumatology (Oxford) 2018;57:451-61.
19 Kanbay M, Ozkara A, Selcoki Y, Isik B, Turgut F, Bavbek N, Zu E, et al. Effect of treatment of hyperuricemia with allopurinol on blood pressure, creatinine clearence, and proteinuria in patients with normal renal functions. Int Urol Nephrol 2007;39:1227-33.
20 Sosa F, Shaban M, Lopez J, Duarte GJ, Jain S, Khizar A, et.al. Impact of Hyperuricemia and Urate-Lowering Agents on Cardiovascular Diseases. Clin Med Insights Cardiol 2024;18:11795468241239542.
21 Latourte A, Soumaré A, Bardin T, Perez-Ruiz F, Debette S, Richette P. Uric acid and incident dementia over 12 years of follow-up: a population-based cohort study. Ann Rheum Dis 2018;77:328-35.
22 Khan AA, Quinn TJ, Hewitt J, Fan Y, Dawson J. Serum uric acid level and association with cognitive impairment and dementia: systematic review and meta-analysis. Age (Dordr) 2016;38:16.
Therapeutische Umschau
- Vol. 81
- Ausgabe 5
- September 2024