- Glukokortikoid-induzierte Osteoporose
Geschichte und Hintergründe
Therapieindikationen für Glukokortikoide (GC) sind vielfältig. So werden GC zur Behandlung von entzündlich-rheumatischen Systemerkrankungen, Allergien, Lungenerkrankungen, Hauterkrankungen, Krankheiten des Nervensystems, onkologischen Krankheiten oder nach Organtransplantation eingesetzt. Nebst der ausgezeichneten Wirkung sind Nebenwirkungen insbesondere auf den Muskel und Knochen häufig.
Diese Übersichtsarbeit beleuchtet die Pathogenese und Therapie der Glukokortikoid-induzierten Osteoporose (GIOP). Die Assoziation zwischen erhöhtem endogenem GC-Spiegel und vertebraler Osteoporose wurde erstmals 1937 durch Harvey Williams Cushing beschrieben. In den 1950er-Jahren wurde dieses Phänomen bei Patienten unter Therapie mit synthetischen GC beobachtet (1). Lange Zeit war jedoch umstritten, ob auch niedrig dosierte GC-Therapien das Osteoporose- und Frakturrisiko erhöhen (2). Heute gilt die GIOP als dritthäufigste Ursache für Osteoporose, nach postmenopausalem und altersassoziiertem Knochenverlust. Weiter stellt die GIOP die häufigste Form der sekundären und iatrogenen Osteoporose dar (1, 3). Die GIOP ist problematisch, denn sie erhöht sowohl Morbidität als auch Mortalität und stellt dadurch eine erhebliche gesellschaftliche Belastung dar (4).
Epidemiologie
Die Prävalenz einer oralen GC-Therapie liegt je nach Population bei 0.8–1.2 % (5–7) und steigt bei Personen über 70 Jahren auf 2.5–3.1 % (8). Von den Patienten mit Langzeit-GC-Therapie erleiden 30–50 % eine osteoporotische Fraktur (9).
Einfluss der unterschiedlichen Darreichungsformen
Zahlreiche nationale und internationale Richtlinien (10–15) und Frakturrisiko-Berechnungsmodelle berücksichtigen wohl die Verabreichung von systemischen GC, nicht aber inhalative, topische und lokal infiltrierte GC-Verabreichungen (10–12, 14, 15).
Systemische Therapien umfassen sowohl orale als auch intravenöse Präparate. Intravenöse GC tragen hauptsächlich zur kumulativen Gesamtdosis bei, werden sie bei Systemerkrankungen bis zu grammweise pro Tag verabreicht, während für Langzeittherapien vor allem orale GC eingesetzt werden. Bereits tägliche Dosierungen von 2.5–7.5 mg Prednison-Äquivalente sind mit einem relativen Risiko (RR) von 2.59 für vertebrale und 1.36 für nicht vertebrale Frakturen assoziiert (16). Die Substitution mit Hydrocortison < 30 mg/Tag bildet eine Ausnahme und führt nicht zu einer GIOP (17). Das Frakturrisiko ist während der ersten drei bis sechs Monate einer GC-Therapie am grössten (18). Es steigt ausserdem mit zunehmendem Alter, höherer Dosierung und längerer Dauer der GC-Therapie (19). Nach Absetzen der GC nimmt das Frakturrisiko zwar ab, bleibt jedoch weiterhin erhöht und kehrt nicht auf das Ausgangsniveau zurück (4). Patienten, die mit GC behandelt werden, haben bei gleicher Knochendichte ein mehrfach erhöhtes Frakturrisiko im Vergleich zu Patienten ohne GC-Behandlung (9). Das RR liegt bei 1.98 im Alter von 50 Jahren und 1.66 im Alter von 85 Jahren (9). Zudem gibt es Hinweise darauf, dass eine orale GC-Therapie mit einer erhöhten Gesamtmortalität assoziiert ist (20).
Selbst bei Therapie mit inhalativen GC bei Asthmatikern konnten Chalitsios et al. zeigen, dass das Risiko für das Auftreten einer Osteoporose und Fraktur im Vergleich zu Asthmatikern ohne inhalative GC signifikant erhöht ist (21). Egeberg et al. beschrieben weiter eine dosisabhängige Erhöhung des Risikos für Osteoporose und osteoporotische Frakturen unter Therapie mit starken und sehr starken topischen GC (22). Anastasilakis et al. fanden zudem Hinweise für einen dosisabhängigen Effekt von epiduralen GC-Injektionen auf die Knochenmineraldichte (23).
Aufgrund der Datenlage darf zusammengefasst werden, dass die nicht systemisch applizierten GC weniger destruktiv auf den Knochen wirken und somit eine sinnvolle Alternative bei der Vermeidung einer GIOP darstellen.
Pathophysiologie der GIOP
Zelluläre Effekte auf den Knochenmetabolismus
Auf zellulärer Ebene aktivieren GC Osteoklasten und hemmen Osteoblasten sowie Osteozyten. Dies führt zu einem vermehrten Knochenabbau und zu einer verminderten Knochenneubildung, wie schematisch in Abb. 1 dargestellt.
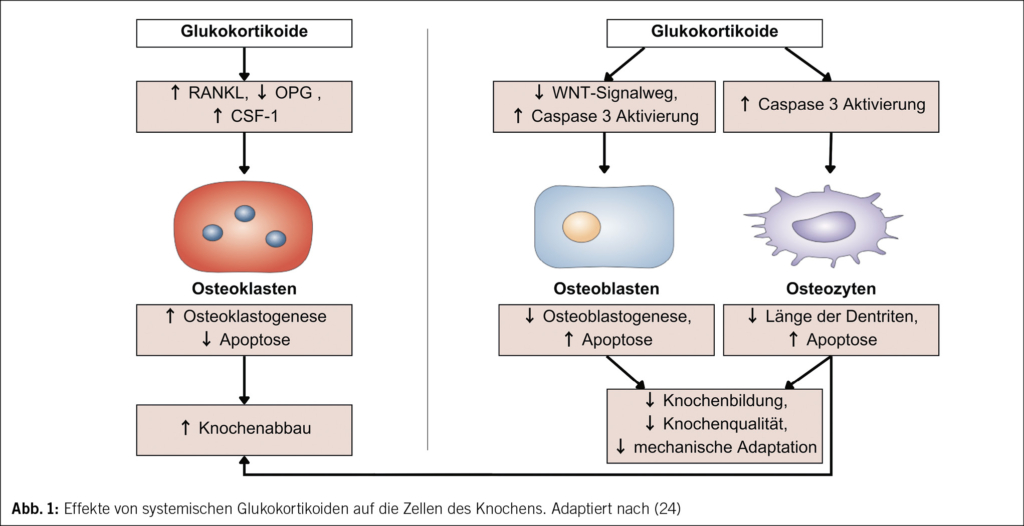
(IGF)-1, die für diesen Prozess entscheidend sind, hemmen. Gleichzeitig fördern GC die Bildung von WNT-Inhibitoren wie Dickkopf-1 und Sklerostin, was die Differenzierung von Osteoblasten zusätzlich reduziert (1). Weiter führen GC zu einer geringeren Differenzierung von Osteoblasten, indem sie einerseits das Differenzierungsverhältnis von multipotenten Stammzellen des Knochenmarks zugunsten von Adipozyten und zulasten der Osteoblasten verschieben und andererseits den Zellzyklus verlangsamen (1). Dieser Effekt beruht unter anderem auf Cyclin A und D, Cyclin-abhängigen Kinasen und auch auf Apoptose-induzierenden Faktoren wie p53, p21 und p27 sowie Aktivierung von Caspase-3 (1, 24). Weiter führen GC zu einer verminderten Sekretion von Kollagen und Osteocalcin (1). Insgesamt führen GC so zu einer reduzierten Knochenbildung und -qualität.
Osteozyten
GC beeinträchtigen weiter auch die Funktion der Osteozyten und induzieren deren Apoptose. Sie beeinflussen einerseits das Lakunen-Canaliculi-System: Die Knochenmatrix um die Osteozyten wird weniger mineralisiert, die Lakunen vergrössern sich, und die Dendriten der Osteozyten werden kürzer (1). Andererseits gibt es Hinweise, dass GC die intraossären Blutgefässe negativ beeinflussen, was zu einer Reduktion der interstitiellen Flüssigkeit und einer schlechteren Versorgung der Osteozyten mit Mineralien und Nährstoffen führt (1). GC-induzierte Abschnürung von apoptotischen Osteozytenbläschen, sogenannten Apoptose-Bodies, aktivieren weiter die Osteoklasten (25) und steigern so indirekt den Knochenabbau. GC führen hierdurch nebst dem Verlust der Knochenmineraldichte und der gestörten Mikrostruktur auch zu einer verminderten Belastbarkeit und Reparationsfähigkeit, was die mehrfach erhöhte Brüchigkeit bei gleicher Knochenmineraldichte erklärt.
Systemische Effekte auf die Muskel-Knochen-Einheit
Systemische GC verringern weiter Muskelmasse und -funktion sowie die Empfindlichkeit des Vitamin D-Rezeptors (3). Darüber hinaus hemmen sie die Synthese und Sekretion von Sexual- sowie Wachstumshormonen (2). Schliesslich kommt es zu einer negativen Calciumbilanz, da GC die intestinale Calciumaufnahme hemmen und gleichzeitig die renale Calciumausscheidung erhöhen (3). All diese Effekte tragen zu einer verminderten Knochenmineralisation bei und erhöhen somit das Risiko für Osteoporose und osteoporotische Frakturen.
Pathogenese der GIOP bei entzündlichen Grunderkrankungen
Bei chronisch-entzündlichen Erkrankungen, wie beispielsweise der rheumatoiden Arthritis oder Morbus Crohn, ist die Pathophysiologie der Osteoporose multifaktoriell (26). Hierbei spielen lokale und systemische Entzündungsprozesse der Grunderkrankung eine zentrale Rolle (26). Proinflammatorische Zytokine wie Tumornekrosefaktor (TNF) alpha, Interleukin(IL)-1 und IL-6 fördern die Aktivität von Osteoklasten, was die Knochenresorption erhöht, während sie die Osteoblastenfunktion und damit die Knochenbildung hemmen (26). Erhöhte Konzentrationen von hochsensitivem C-reaktivem Protein (hs-CRP), einem Marker für Entzündungsaktivität, wurden als unabhängiger Risikofaktor für nicht traumatische Frakturen identifiziert. Dies gilt selbst bei geringfügigen hs-CRP-Erhöhungen (27). Weitere Faktoren wie Malabsorption und reduzierte körperliche Aktivität sind zudem für die Entstehung einer entzündungsbedingten Osteoporose ursächlich (26).
Abklärungsalgorithmus
Patienten mit geplanter oder bereits laufender GC-Therapie aller Applikationsformen sind im Hinblick auf eine mögliche GIOP abzuklären. Einerseits gilt es, anamnestisch sekundäre Risikofaktoren zu erfassen, und andererseits zum Ausschluss anderer sekundärer Osteoporoseformen eine laboranalytische Bestimmung von Albumin-korrigiertem Calcium, Phosphat, Kreatinin, alkalischer Phosphatase (AP), Gamma-GT, Blutbild, Blutsenkungsreaktion, CRP, TSH und 25(OH)Vitamin D3 durchzuführen (3). Bei Verdacht auf Multiples Myelom ist zudem eine Serumeiweisselektrophorese angezeigt (3). Die obligatorische Krankenpflegeversicherung (OKP) deckt bei Osteoporoseverdacht Vitamin D-Messungen alle drei Monate (28).
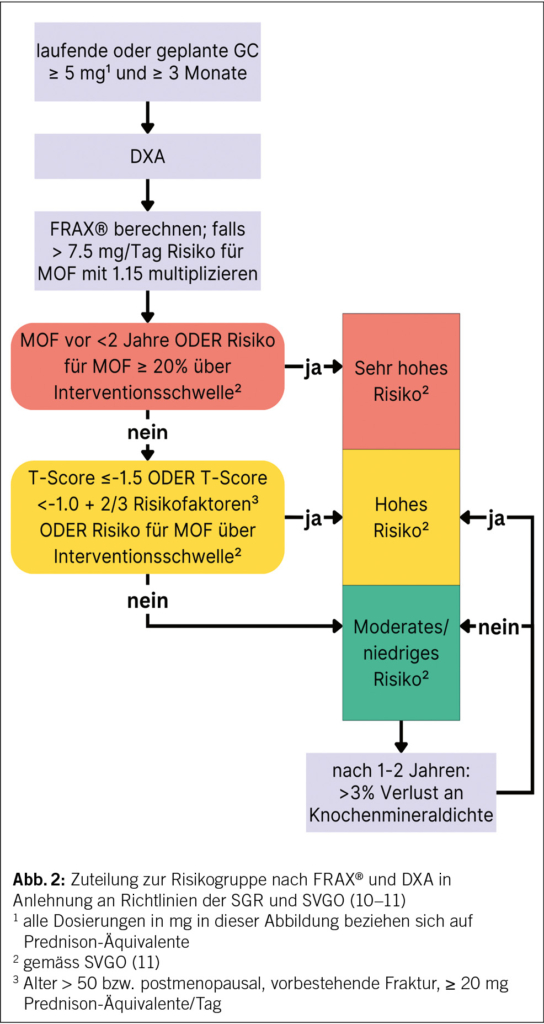
Weiter empfehlen wir bei Patienten über 40 Jahren das Berechnen des individuellen 10-Jahres-Risikos einer Osteoporose-typischen Fraktur (MOF = major osteoporotic fracture: hüftnahe Frakturen, klinische Wirbelkörperfrakturen, Humerusfrakturen und Unterarmfrakturen). In der Schweiz stehen dazu zwei Instrumente zur Verfügung: Erstens FRAX® (https://frax.shef.ac.uk/FRAX/tool.aspx?lang=de), welches international validiert ist, und zweitens das Berechnungsmodul der Osteoporose-Plattform (https://www.osteorheuma.ch/top/) (8, 12). Beide basieren auf Daten aus der Schweiz. FRAX® berücksichtigt aktuelle und frühere Gaben von ≥ 5 mg Prednison-Äquivalente/Tag über mindestens drei Monate. Ergänzend empfehlen wir, das MOF-Risiko bei Prednison-Äquivalenzdosierungen > 7.5 mg täglich um den Faktor 1.15 anzupassen (29). Bei GIOP-Patienten mit entzündlichen Grunderkrankungen gilt ausserdem zu beachten, dass FRAX® stellvertretend für alle entzündlichen Erkrankungen die rheumatoide Arthritis als Risikofaktor hinterlegt hat.
Ergänzend zur Risikoberechnung ist baldmöglichst eine Knochendichtemessung mittels dual energy X-ray absorptiometry (DXA) in Kombination mit einer vertebralen Frakturanalyse (VFA) empfohlen (10, 11). Die OKP übernimmt die Kosten bei einer Langzeit-GC-Therapie (30), darunter wird üblicherweise eine Therapie mit einem Prednison-Äquivalent ≥ 5 mg während ≥ drei Monaten verstanden.
Gemäss den schweizerischen Richtlinien (10, 11) können postmenopausale Patientinnen und Patienten ab 40 Jahren anhand der klinischen und diagnostischen Parameter mithilfe des Algorithmus in Abb. 2 in Risikogruppen eingeteilt werden. Patienten unter 40 Jahren sowie prämenopausale Frauen werden in den schweizerischen Richtlinien nicht berücksichtigt. Laut US-amerikanischen Leitlinien fallen diese bei vorangegangener MOF, täglichen Prednison-Äquivalenzdosen von ≥ 30 mg/Tag oder kumulativ > 5 g/Jahr in die Kategorie «sehr hohes Risiko» (12).
Patienten mit GIOP sind im Vergleich zu Patienten mit anderen Osteoporoseformen jünger, häufiger männlich, häufiger ohne abgeschlossene Familienplanung und haben durch GC-Therapien in der Jugend und aufgrund der entzündlichen Grunderkrankungen häufiger eine tiefere maximale Knochenmasse. Diese Faktoren gilt es, bei der Wahl der Therapie weiter zu berücksichtigen.
Therapie der GIOP
Alle Patienten mit einer langfristigen GC-Therapie benötigen eine adäquate Osteoporoseprophylaxe bzw. -therapie (10). Dazu existieren, wie bereits erwähnt, verschiedene nationale und internationale Richtlinien, unter anderem von der Schweizerischen Gesellschaft für Rheumatologie (SGR) (10), der Schweizerischen Vereinigung gegen Osteoporose (SVGO) (11), dem American College of Rheumatology (ACR) (12), dem Dachverband Osteologie e.V. (13) sowie von Tanaka et al. für Japan (14) und van den Bergh et al. für die Niederlande (15). Vergleicht man diese untereinander, finden sich einerseits Gemeinsamkeiten, wie zum Beispiel die Einteilung in prä- oder postmenopausal bzw. in Altersgruppen. Eine weitere Gemeinsamkeit stellen die Empfehlungen betreffend den allgemeinen Massnahmen dar. Andererseits fällt auf, dass die internationalen Richtlinien im Gegensatz zu den schweizerischen eine tiefere Interventionsschwelle haben. Zum Beispiel empfiehlt das ACR bereits bei T-Werten von < –1.0 eine Therapie, während die SVGO eine solche erst bei T-Werten < –1.5 empfiehlt. Schliesslich empfehlen die internationalen Richtlinien bei GIOP prinzipiell eine Therapie mit Teriparatid. Dies basiert auf Daten, wie denen einer Metaanalyse von Liu et al., die kürzlich zeigen konnten, dass Teriparatid im Vergleich zu Alendronat bei GIOP-Patienten Wirbelkörperfrakturen signifikant stärker verringert und die Knochenmineraldichte signifikant erhöht (31).
Allgemeine Massnahmen
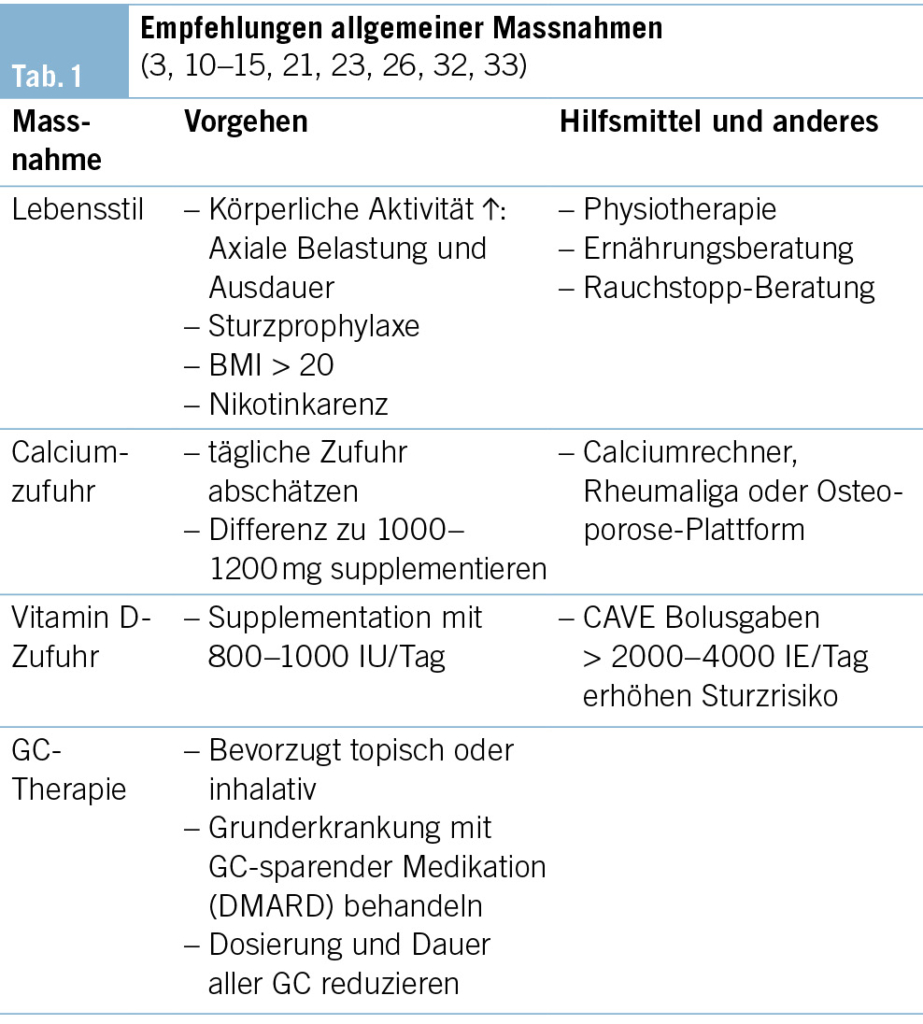
Folgende Massnahmen (Tab. 1) werden allen GIOP-Patienten, ungeachtet deren Alter und Frakturrisiko, empfohlen (10–15).
Empfehlungen betreffend osteologischer Therapie
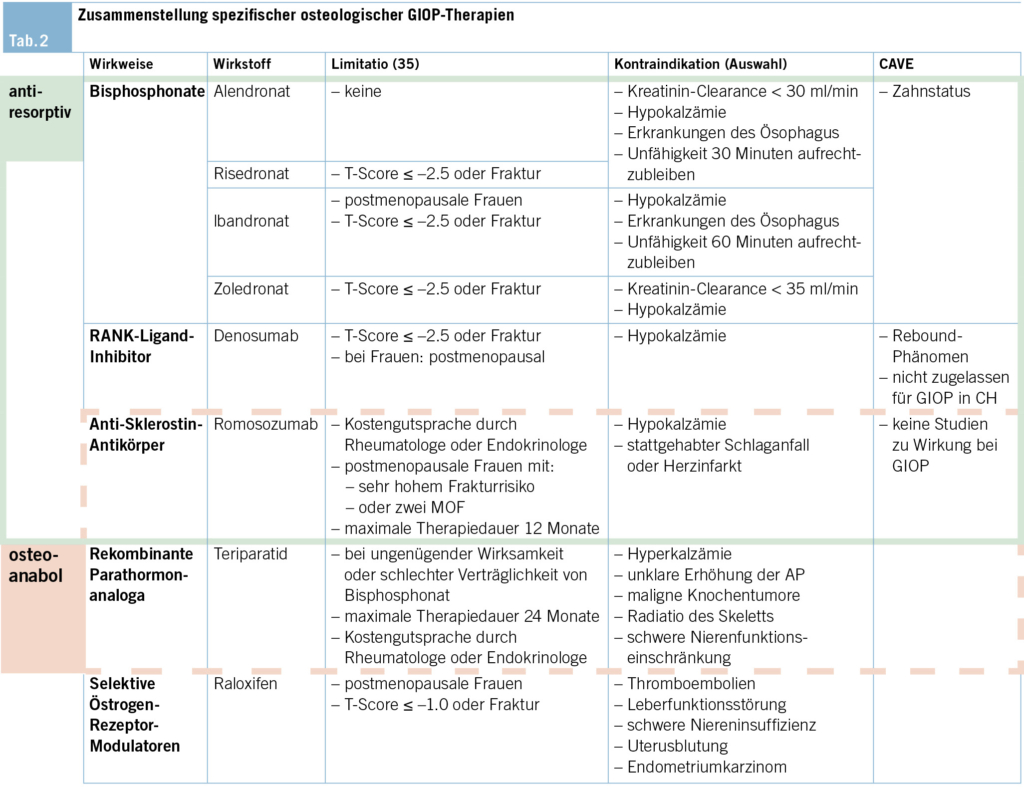
Bei der GIOP kommen die üblichen antiresorptiven und osteoanabolen Wirkstoffe zum Einsatz, diese sind in Tab. 2 aufgeführt. Die Wahl der spezifischen Therapie orientiert sich an den nationalen Richtlinien, der Zulassung und den Limitationen zur Vergütung der Medikamente. Dabei gibt es Diskrepanzen, welche dadurch zustande kommen, dass die Zulassungsstudien hauptsächlich an postmenopausalen Frauen durchgeführt werden, wie zum Beispiel die HORIZON-Studie für Zoledronat (34). Da die Limitationen laufend angepasst werden, empfehlen wir, diese vor einem Therapiebeginn zu überprüfen (35). Ausserdem gilt es, das Alter des Patienten, das individuelle Frakturrisiko, die Komorbiditäten sowie die Compliance bzw. die Patientenwünsche zu beachten.
Da das Frakturrisiko bei GIOP insbesondere zu Beginn der Therapie sehr hoch ist, könnte, sofern die Wartezeit auf eine DXA länger ist, bereits eine vorübergehende Therapie mit einem oralen Bisphosphonat, z. B. Alendronat, erwogen werden.
Osteologische Therapie bei Männern ≥ 40 Jahre und postmenopausalen Frauen
Sehr hohes Risiko
Bei Patienten mit sehr hohem Frakturrisiko sollte eine osteoanabole Therapie mit Teriparatid oder Romosozumab in Betracht gezogen werden (10, 11). Für beide Wirkstoffe ist jedoch eine Konsultation bzw. eine Kostengutsprache durch einen Facharzt FMH Rheumatologie oder Endokrinologie an die OKP erforderlich (35). Alternativ kann eine potente antiresorptive Therapie, z. B. Zoledronat, angewendet werden (10, 11).
Hohes Risiko
Bei hohem Frakturrisiko wird eine potente antiresorptive Therapie empfohlen (10, 11). In der Schweiz ist Denosumab nicht zur Behandlung von GIOP zugelassen, entsprechend handelt es sich um eine Off-label-Anwendung (11). Bei sehr tiefen T-Scores soll eine osteoanabole Therapie evaluiert werden.
Moderates/niedriges Risiko
Falls keine Östrogenersatztherapie besteht, kann der Einsatz eines selektiven Östrogen-Rezeptor-Modulators (SERM) geprüft werden. Eine Therapie mit Bisphosphonaten kann gemäss den Empfehlungen der SVGO erwogen werden (11).
Osteologische Therapie bei Männern < 40 Jahre und prämenopausalen Frauen
Prämenopausale Frauen und Patienten < 40 Jahre stellen einen wesentlichen Anteil der GIOP-Patienten dar, sind jedoch in klinischen Studien zur Osteoporosetherapie stark unterrepräsentiert (31). Während Studien zeigen, dass gängige Therapien die Knochenmineraldichte erhöhen (36), sind uns keine Analysen zum Frakturrisiko dieser Patientengruppe bekannt. Wohl daher sprechen die meisten Leitlinien keine spezifischen Empfehlungen aus. Eine Ausnahme bildet die ACR-Richtlinie, die in Hochrisikosituationen Bisphosphonate empfiehlt – bei Frauen jedoch nur in Kombination mit wirksamer Kontrazeption (12). Weiter sind Bisphosphonate sechs Monate vor geplanter Schwangerschaft abzusetzen. Bei dieser Patientengruppe ist eine individuelle Risiko-Nutzen-Abwägung, die Frakturrisiko, potenziellen Kinderwunsch und Sicherheitsprofile der Therapien berücksichtigt, sinnvoll (36). Ungeachtet davon sollten die oben genannten allgemeinen Massnahmen konsequent umgesetzt werden.
Empfehlungen zur Folgetherapie
Eine Wiederholung der DXA wird alle zwei Jahre empfohlen, danach und bei neu aufgetretenen MOF oder nach Absetzen der GC sollte eine Reevaluation der Therapie erfolgen (10–12). Die Wahl der Folgetherapie hängt vom Frakturrisiko und der initialen Therapie ab. Ziel ist es, die erreichte Knochenmineraldichte langfristig zu konsolidieren und das Frakturrisiko weiter zu reduzieren.
Nach Absetzen von Denosumab oder dem Auslassen einer Dosis kommt es zu einem raschen, massiven Knochenverlust (Rebound-Phänomen) (13). Auch nach dem Absetzen von Teriparatid und Romosozumab wird ein schneller Verlust an Knochenmineraldichte beobachtet (13). Deshalb ist nach Therapie mit Denosumab, Teriparatid oder Romosozumab eine antiresorptive Folgetherapie unerlässlich (10, 13). Darüber sind Patienten bereits vor der initialen Therapie aufzuklären (13).
Der Zeitpunkt des Übergangs zur Folgetherapie variiert je nach initial eingesetztem Wirkstoff (12):
– nach Romosozumab: Beginn der Folgetherapie einen Monat nach letzter Gabe
– nach Teriparatid: Beginn der Folgetherapie einen Tag nach letzter Gabe
– nach Denosumab: Beginn der Folgetherapie sechs Monate nach letzter Gabe
Zusammenfassend kann gesagt werden, dass GC, selbst in niedriger Dosierung, zu einem Verlust an Knochenmasse und -qualität führen. Daher sollte ihr Einsatz auf die niedrigste wirksame Dosierung und die kürzeste mögliche Dauer begrenzt werden. Prophylaktisch sollten Calcium und Vitamin D supplementiert werden, ergänzt durch regelmässige körperliche Aktivität und Sturzprophylaxe. Bei geplanter GC-Therapie von ≥ drei Monaten sollten eine Knochendichtemessung mittels DXA sowie eine klinische Einschätzung des Frakturrisikos durchgeführt werden. Die Wahl der spezifischen Osteoporosetherapie richtet sich nach dem Alter des Patienten und dem individuellen Frakturrisiko.
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Gado M, Baschant U, Hofbauer LC, Henneicke H. Bad to the Bone: The Effects of Therapeutic Glucocorticoids on Osteoblasts and Osteocytes. Front Endocrinol (Lausanne). 2022;13:835720.
2. van Staa TP. The pathogenesis, epidemiology and management of glucocorticoid-induced osteoporosis. Calcified tissue international. 2006;79(3):129-37.
3. Amann J, Lang A, Hoff P, Buttgereit F. Glukokortikoidinduzierte Osteoporose. In: Kurth A, Lange U, editors. Fachwissen Osteologie. München: Urban & Fischer Verlag/Elsevier GmbH; 2018. 96-9.
4. Urquiaga M, Saag KG. Risk for osteoporosis and fracture with glucocorticoids. Best Pract Res Clin Rheumatol. 2022;36(3):101793.
5. Fardet L, Petersen I, Nazareth I. Prevalence of long-term oral glucocorticoid prescriptions in the UK over the past 20 years. Rheumatology. 2011;50(11):1982-90.
6. Overman RA, Yeh JY, Deal CL. Prevalence of oral glucocorticoid usage in the United States: a general population perspective. Arthritis care & research. 2013;65(2):294-8.
7. Einarsdottir MJ, Ekman P, Trimpou P, Olsson DS, Johannsson G, Ragnarsson O. High prescription rate of oral glucocorticoids in children and adults: A retrospective cohort study from Western Sweden. Clin Endocrinol (Oxf). 2020;92(1):21-8.
8. Chen JF, Yu SF, Chiu WC, Ko CH, Hsu CY, Lai HM, et al. Development and Comparison of Treatment Decision Tools for Glucocorticoid-Induced Osteoporosis. Diagnostics (Basel). 2024;14(4).
9. Rizzoli R, Biver E. Glucocorticoid-induced osteoporosis: who to treat with what agent? Nat Rev Rheumatol. 2015;11(2):98-109.
10. Schweizerische Gesellschaft für Rheumatologie. Glukokortikoid-Osteoporose Vorbeugung und Behandlung (Internet). (abgerufen am 31. Dezember 2024). Verfügbar unter: https://www.rheuma-net.ch/de/doc/glukokortikoid-osteoporose-vorbeugung-und-behandlung/viewdocument/616
11. Ferrari S, Lippuner K, Lamy O, Meier C. 2020 recommendations for osteoporosis treatment according to fracture risk from the Swiss Association against Osteoporosis (SVGO). Swiss Med Wkly. 2020;150:w20352.
12. Humphrey MB, Russell L, Danila MI, Fink HA, Guyatt G, Cannon M, et al. 2022 American College of Rheumatology Guideline for the Prevention and Treatment of Glucocorticoid-Induced Osteoporosis. Arthritis Rheumatol. 2023;75(12):2088-102.
13. Dachverband Osteologie e.V. DVO Leitlinie zur Diagnostik und Therapie der Osteoporose 2023 (Internet). (abgerufen am 31. Dezember 2024). Verfügbar unter: https://leitlinien.dv-osteologie.org/
14. Tanaka Y, Soen S, Hirata S, Okada Y, Fujiwara S, Tanaka I, et al. The 2023 Guidelines for the management and treatment of glucocorticoid-induced osteoporosis. J Bone Miner Metab. 2024;42(2):143-54.
15. van den Bergh JP, Geusens P, Appelman-Dijkstra NM, van den Broek HJG, Elders PJM, de Klerk G, et al. The Dutch multidisciplinary guideline osteoporosis and fracture prevention, taking a local guideline to the international arena. Arch Osteoporos. 2024;19(1):23.
16. van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Use of oral corticosteroids and risk of fractures. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2000;15(6):993-1000.
17. Furman K, Gut P, Sowińska A, Ruchała M, Fichna M. Predictors of bone mineral density in patients receiving glucocorticoid replacement for Addison’s disease. Endocrine. 2024;84(2):711-9.
18. van Staa TP, Leufkens HGM, Cooper C. The Epidemiology of Corticosteroid-Induced Osteoporosis: a Meta-analysis. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2002;13(10):777-87.
19. Sato AY, Peacock M, Bellido T. Glucocorticoid Excess in Bone and Muscle. Clin Rev Bone Miner Metab. 2018;16(1):33-47.
20. Einarsdottir MJ, Ekman P, Molin M, Trimpou P, Olsson DS, Johannsson G, et al. High Mortality Rate in Oral Glucocorticoid Users: A Population-Based Matched Cohort Study. Front Endocrinol (Lausanne). 2022;13:918356.
21. Chalitsios CV, Shaw DE, McKeever TM. Corticosteroids and bone health in people with asthma: A systematic review and meta-analysis. Respir Med. 2021;181:106374.
22. Egeberg A, Schwarz P, Harslof T, Andersen YMF, Pottegard A, Hallas J, et al. Association of Potent and Very Potent Topical Corticosteroids and the Risk of Osteoporosis and Major Osteoporotic Fractures. JAMA Dermatol. 2021;157(3):275-82.
23. Anastasilakis AD, Naciu AM, Yavropoulou MP, Paccou J. Risk and management of osteoporosis due to inhaled, epidural, intra-articular or topical glucocorticoids. Joint Bone Spine. 2023;90(6):105604.
24. Compston J. Management of glucocorticoid-induced osteoporosis. Nat Rev Rheumatol. 2010;6(2):82-8.
25. Aeberli D, Oertle S. Glucokortikoid-induzierte Osteoporose: Pathogenese und Therapie. Schweiz Med Forum. 2013;13(40):789–93.
26. Buttgereit F, Palmowski A, Bond M, Adami G, Dejaco C. Osteoporosis and fracture risk are multifactorial in patients with inflammatory rheumatic diseases. Nat Rev Rheumatol. 2024;20(7):417-31.
27. Schett G, Kiechl S, Weger S, Pederiva A, Mayr A, Petrangeli M, et al. High-Sensitivity C-Reactive Protein and Risk of Nontraumatic Fractures in the Bruneck Study. Archives of internal medicine. 2006;166(22):2495-501.
28. Bundesamt für Gesundheit. Analysenliste per 1. Januar 2025 (Internet). (abgerufen am 31. Dezember 2024). Verfügbar unter: https://www.bag.admin.ch/bag/de/home/versicherungen/krankenversicherung/krankenversicherung-leistungen-tarife/Analysenliste.html
29. Kanis JA, Johansson H, Oden A, McCloskey EV. Guidance for the adjustment of FRAX according to the dose of glucocorticoids. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2011;22(3):809-16.
30. Bundesamt für Gesundheit. Krankenpflege-Leistungsverordnung Anhang 1 per 1.1.2025 (Internet). (abgerufen am 31. Dezember 2024). Verfügbar unter: https://www.bag.admin.ch/bag/de/home/versicherungen/krankenversicherung/krankenversicherung-leistungen-tarife/Aerztliche-Leistungen-in-der-Krankenversicherung/anhang1klv.html
31. Liu ZM, Zhang M, Zong Y, Zhang D, Shen ZB, Guan XQ, et al. The efficiency and safety of alendronate versus teriparatide for treatment glucocorticoid-induced osteoporosis: A meta-analysis and systematic review of randomized controlled trials. PloS one. 2022;17(5):e0267706.
32. Sanders KM, Stuart AL, Williamson EJ, Simpson JA, Kotowicz MA, Young D, et al. Annual High-Dose Oral Vitamin D and Falls and Fractures in Older Women A Randomized Controlled Trial. JAMA. 2010;303(18):1815-22.
33. EFSA NDA Panel (EFSA Panel on Dietetic Products NaA. Scientific Opinion on Dietary Reference Values for calcium. EFSA Journal. 2015;13(5):4101.
34. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, et al. Once-Yearly Zoledronic Acid for Treatment of Postmenopausal Osteoporosis. The New England journal of medicine. 2007;356(18):1809-22.
35. Bundesamt für Gesundheit. Spezialitätenliste (Internet). (abgerufen am 31. Dezember 2024). Verfügbar unter: www.spezialitätenliste.ch
36. Chakrabarti K, McCune WJ. Glucocorticoid-induced osteoporosis in premenopausal women: management for the rheumatologist. Curr Opin Rheumatol. 2023;35(3):161-9.





