- Herzinsuffizienz mit erhaltener linksventrikulärer Auswurffraktion (HFpEF)
Zusammenfassung: Herzinsuffizienz mit erhaltener linksventrikulärer Auswurffraktion (heart failure with preserved ejection fraction; HFpEF) ist ein häufiges und im Alltag wichtiges Krankheitsbild, da HFpEF mit wiederholten Hospitalisationen und substanzieller Mortalität assoziiert ist. Pathophysiologische Hauptmerkmale der Erkrankung umfassen den kleinen linken Ventrikel mit konzentrischem Remodeling und gestörter Compliance sowie eine linksatriale Dysfunktion. Dies führt in Kombination zu einem Anstieg des linksatrialen und pulmonalen Drucks, zunächst nur unter Belastung und bei Progredienz auch in Ruhe und somit zu Belastungsdyspnoe und Leistungsintoleranz. Zusätzliche kardiovaskuläre Mechanismen (Vorhofflimmern, chronotrope Inkompetenz, koronare Herzkrankheit) und nicht kardiovaskuläre Komorbiditäten tragen in individuell unterschiedlichem Ausmass zu diesem Symptomkomplex bei. Die Diagnostik ist aufwendig und relativ komplex, aber zunehmend besser definiert. Die therapeutischen Optionen haben sich mit den neuen Daten zu den Sodium-Glucose cotransporter-2 inhibitors (SGLT2i) entscheidend verbessert. Im vorliegenden Artikel möchten wir eine Übersicht über das aktuelle Verständnis der Pathophysiologie von HFpEF, die Prinzipien der Diagnostik und die wichtigsten Daten aus den Interventionsstudien vermitteln und einen praktischen Therapieansatz aufzeigen.
Heart failure with preserved left ventricular ejection fraction (HFpEF)
Abstract: Heart failure with preserved left ventricular ejection fraction (HFpEF) is a common and very important disease entity because of its association with frequent repeat hospitalization and high mortality. Hallmarks of the underlying pathophysiology include a small left ventricular cavity due to concentric remodeling, impaired left ventricular compliance and left atrial dysfunction. This leads to an increase in left atrial and pulmonary pressure on exertion and in advanced stages of the disease already at rest with consecutive exertional dyspnea and exercise intolerance. Additional cardiovascular mechanisms including atrial fibrillation, chronotropic incompetence and coronary artery disease as well as non-cardiac co-morbidities contribute to a variable extent to the clinical picture. The diagnostic work-up is demanding and complex but the concepts have significantly improved during the last years. The study results of the Sodium Glucose cotransporter-2 inhibitors (SGLT-2-inhibitors) have revolutionized the treatment of HFpEF. In the present article, we provide an overview about the current understanding of the pathophysiology of HFpEF, the principles of the diagnostic pathways and a summary of the intervention studies in the field, and we propose an approach for the treatment in clinical practice.
Einleitung
Die Herzinsuffizienz mit erhaltener linksventrikulärer Auswurffraktion (left ventricular ejection fraction, LVEF; heart failure with preserved ejection fraction, HFpEF) hat sich von einer zunächst angezweifelten Entität zu einem etablierten Krankheitsbild entwickelt. Neu liegen mit den Sodium-Glucose cotransporter-2 inhibitors (SGLT2i) wirksame Medikamente zur Behandlung von Patientinnen und Patienten mit HFpEF vor, sodass die komplexe Diagnostik nicht mehr nur akademischen Charakter hat. Der vorliegende Artikel soll eine aktuelle Übersicht über die Pathophysiologie von HFpEF, den diagnostischen Ansatz und die Datenlage der relevanten Therapiestudien vermitteln.
Epidemiologie
Daten aus den USA suggerieren, dass die Inzidenz von HFpEF zunimmt (27 Fälle pro 100 000 Patientenjahre) und die Prävalenz der Herzinsuffizienz mit reduzierter LVEF (HFrEF) in den nächsten Jahren übersteigen wird. Während beispielsweise in der Behandlung des akuten Myokardinfarkts grosse Fortschritte gemacht wurden, was die Inzidenz von HFrEF günstig beeinflusst, sind Adipositas und Diabetes, die wichtigsten für HFpEF prädisponierenden Entitäten, weltweit auf dem Vormarsch. Traditionellerweise finden wir HFpEF bei älteren Frauen mit arterieller Hypertonie und Vorhofflimmern (old ladies heart), was immer noch Gültigkeit hat. Daneben existiert aber ein zunehmend häufiger metabo-inflammatorischer Phänotyp, der vor allem bei jüngeren Männern wichtig ist (1). Die Prognose von HFpEF ist trotz «erhaltener» LVEF nicht benigne, sondern insgesamt vergleichbar zu HFrEF.
Pathophysiologie
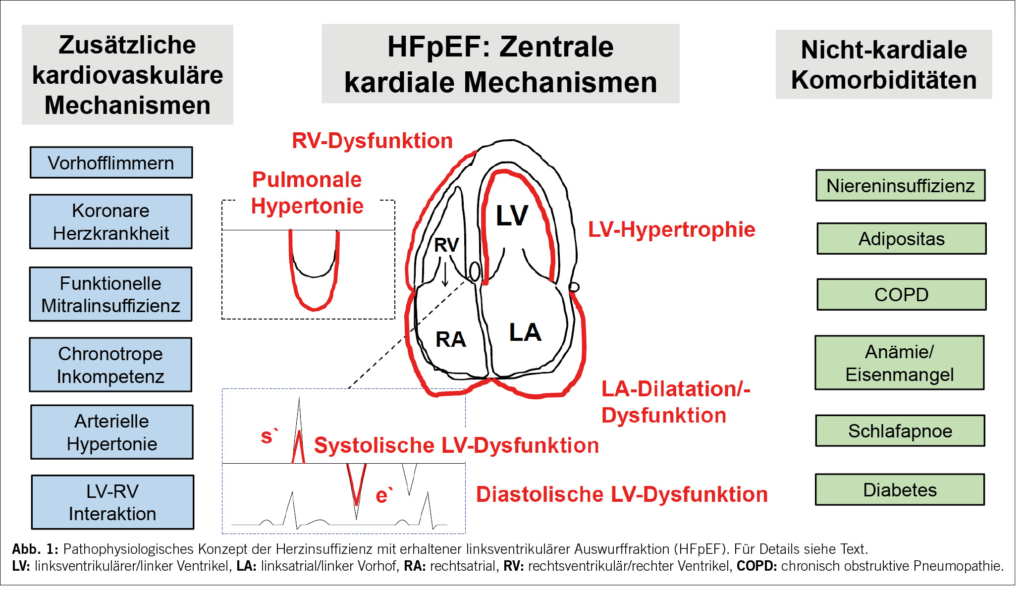
Patientinnen und Patienten mit HFpEF sind per definitionem charakterisiert durch eine LVEF ≥50% (2), was in der Regel mit einer normalen linksventrikulären Grösse und einem konzentrischen Remodeling einhergeht, obschon dies in der Definition nicht mehr explizit verlangt wird. Es ist unterdessen klar, dass eine «erhaltene» LVEF nicht bedeutet, dass die systolische linksventrikuläre Funktion normal ist. Häufig liegt eine Störung der Längsverkürzung vor, was mittels Tissue Doppler oder strain imaging erfassbar ist. Kennzeichnend für HFpEF (früher «diastolische Herzinsuffizienz») und im Zentrum der Diagnostik (vgl. unten) ist eine Störung der diastolischen linksventrikulären Funktion. Der linke Ventrikel weist eine Füllungsbehinderung auf (verminderte Compliance), was sowohl durch eine Störung der aktiven Relaxation als auch eine erhöhte passive Steifigkeit bedingt ist. Letztere wird durch die Kardiomyozyten (Hypertrophie und erhöhte Ruhespannung), aber auch das Interstitium (Fibrose) vermittelt. Der linke Ventrikel ist durch eine nach links und oben verschobene end-diastolische Druck-Volumen-Beziehung charakterisiert. Dies bedeutet konkret, dass der linksventrikuläre end-diastolische Druck bei einem bestimmten end-diastolischen Volumen bei HFpEF höher als bei «nicht-HFpEF» ist. Entsprechend kommt es bei HFpEF-Patientinnen und Patienten bei erhöhtem venösen Rückfluss (körperliche Belastung, Volumenzufuhr) zu einem überproportionalen Anstieg des LV-Füllungsdrucks und dadurch auch des linksatrialen Drucks, dies bei gleichzeitig nur geringer Steigerung von end-diastolischem Volumen und Schlagvolumen. Praktisch lässt sich das durch eine Rechtsherzkatheteruntersuchung mit körperlicher Belastung abbilden, wo es in der HFpEF-Situation zu einem stärkeren Anstieg des Wedge-Drucks (pulmonary artery wedge pressure, PAWP) als Ausdruck einer linksatrialen Hypertonie kommt (3). Neben der linksventrikulären Funktionsstörung ist die linksatriale Dysfunktion ein zentrales pathophysiologisches Element (1). Diese ist typischerweise die Folge einer linksventrikulären Füllungsstörung und vermittelt häufig in Kombination mit einer funktionellen Mitralinsuffizienz (sogenannte «atriale Mitralinsuffizienz») den Druckanstieg im Vorhof und in den Lungenvenen. Im weiter fortgeschrittenen Stadium kommt es zu einer chronischen pulmonalen Drucksteigerung, welche zunächst rein passiv bedingt ist durch den erhöhten linksatrialen Druck (isolierte post-kapilläre pulmonale Hypertonie), aber im Verlauf durch eine zusätzliche prä-kapilläre Komponente (pulmonalvaskuläres Remodeling) kompliziert werden kann (kombiniert prä- und post-kapilläre pulmonale Hypertonie). Dies wiederum führt früher oder später zu einer rechtsventrikulären Funktionsstörung und Dilation, einer funktionellen Trikuspidalinsuffizienz und einem erhöhten rechtsatrialen Druck. Neben dieser klassischen progressiven «Rückstau-Pathophysiologie» sind zusätzliche Aspekte zu bedenken. Erstens kommt es zu einer ventrikulären Interaktion via das gemeinsame Septum und das Perikard («ventrikuläre Interdependenz»), wobei dem pericardial restraint insbesondere bei schwerer Adipositas eine zentrale Rolle zugeschrieben wird. Zweitens ist die Entwicklung einer rechtsventrikulären und einer (bi-)atrialen Dysfunktion auch unabhängig vom linksventrikulären Druck möglich, insbesondere wenn es zu Vorhofflimmern gekommen ist. Drittens können weitere Faktoren eine Rolle spielen, wie ein erhöhter peripherer Widerstand bzw. abnormes «ventriculo-arterielles Coupling» (ungünstige Abstimmung von Ventrikel- und Gefässsteifigkeit), eine koronare Herzkrankheit und/oder eine chronotrope Inkompetenz. Die wesentlichen kardiovaskulären Mechanismen bei HFpEF sind in Abbildung 1 schematisch zusammengefasst.
Während initial die klassische Pathophysiologie der hypertensiven Herzkrankheit als HFpEF-Prototyp im Zentrum stand, wurde inzwischen klar, dass dieses Modell nicht bei allen Patientinnen und Patienten mit HFpEF erklärend ist und dass HFpEF nicht generell eine left ventricular pressure overload condition ist. Als Ursache der diskutierten kardiovaskulären Dysfunktion bei HFpEF wird aktuell eine entzündlich bedingte endotheliale Funktionsstörung (insbesondere der koronaren Mikrozirkulation) propagiert (4). Zentral bei diesem Modell ist eine verminderte Verfügbarkeit von nitric oxide (NO) mit konsekutiver zellulär reduzierter Aktivität/Verfügbarkeit von löslicher Guanylatzyklase, zyklischem Guanosinmonophosphat und Proteinkinase G. Adipositas und Diabetes werden als die zentralen Driver eines pro-inflammatorischen Zustands in der Pathogenese des «metabo-inflammatorischen Phänotyps» angesehen. Neben der kardialen Funktionsstörung wird eine Dysfunktion der Skelettmuskulatur diskutiert. Durch die verminderte Fähigkeit der Muskulatur, Sauerstoff aus dem Blut zu extrahieren und zu metabolisieren, wird die maximale Sauerstoffaufnahme zusätzlich kompromittiert. Aktuell gehen wir von der Existenz verschiedener HFpEF-Phänotypen aus (phenotype diversity). Diese unterscheiden sich durch unterschiedliche Profile bezüglich prädominanter kardiovaskulärer Mechanismen und dem Spektrum der Komorbiditäten (Abbildung 1). Dieses Konzept kann den fehlenden Effekt vieler bisher untersuchter Interventionen in unselektionierten HFpEF-Populationen erklären und verlangt nach einem individualisierten Behandlungsansatz.
Diagnostik
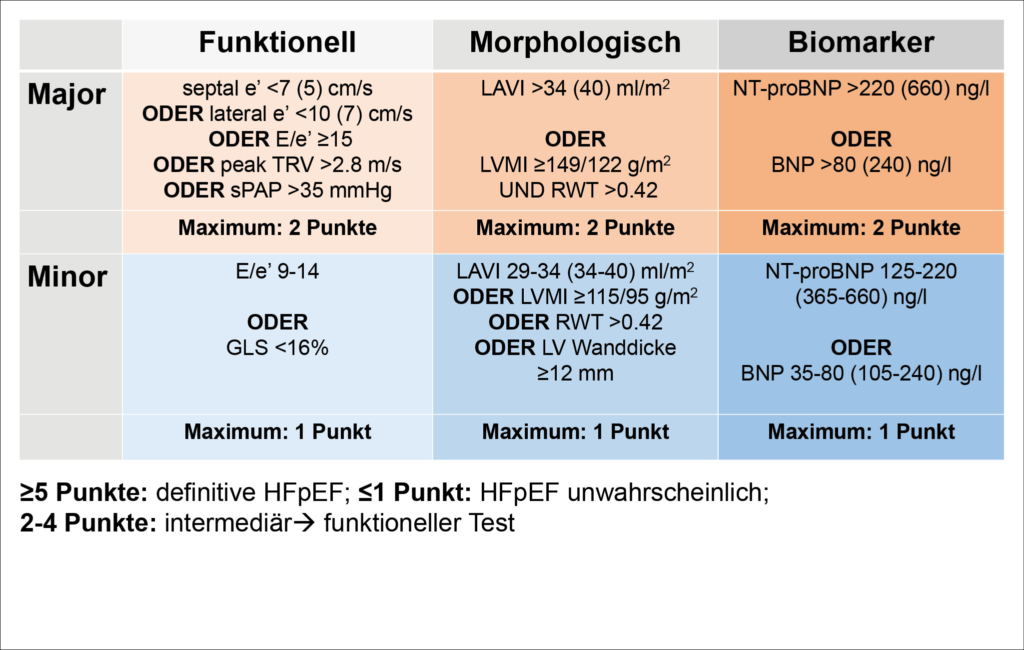
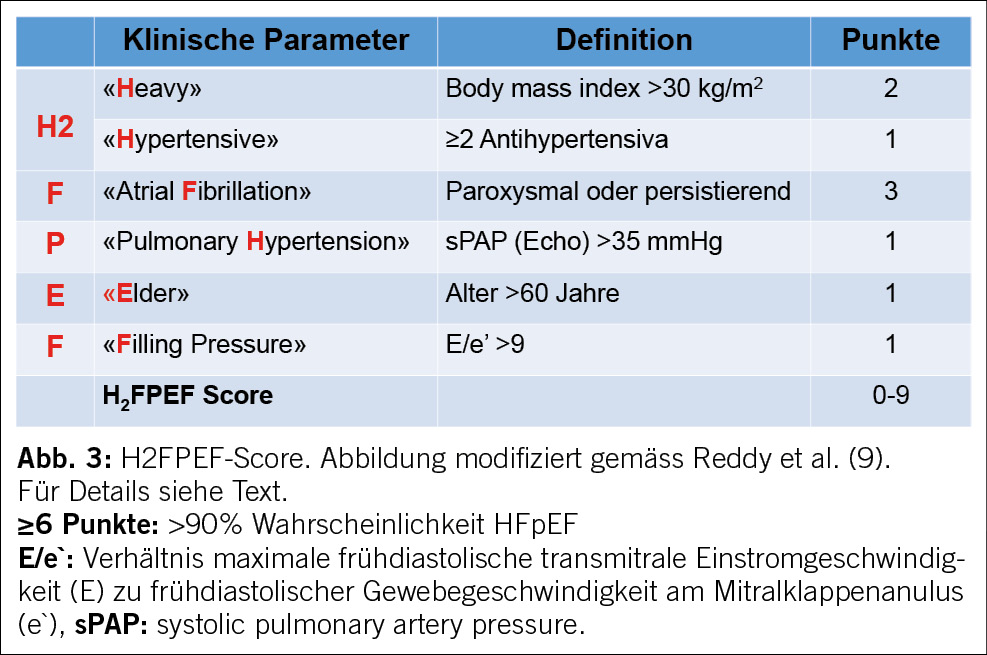
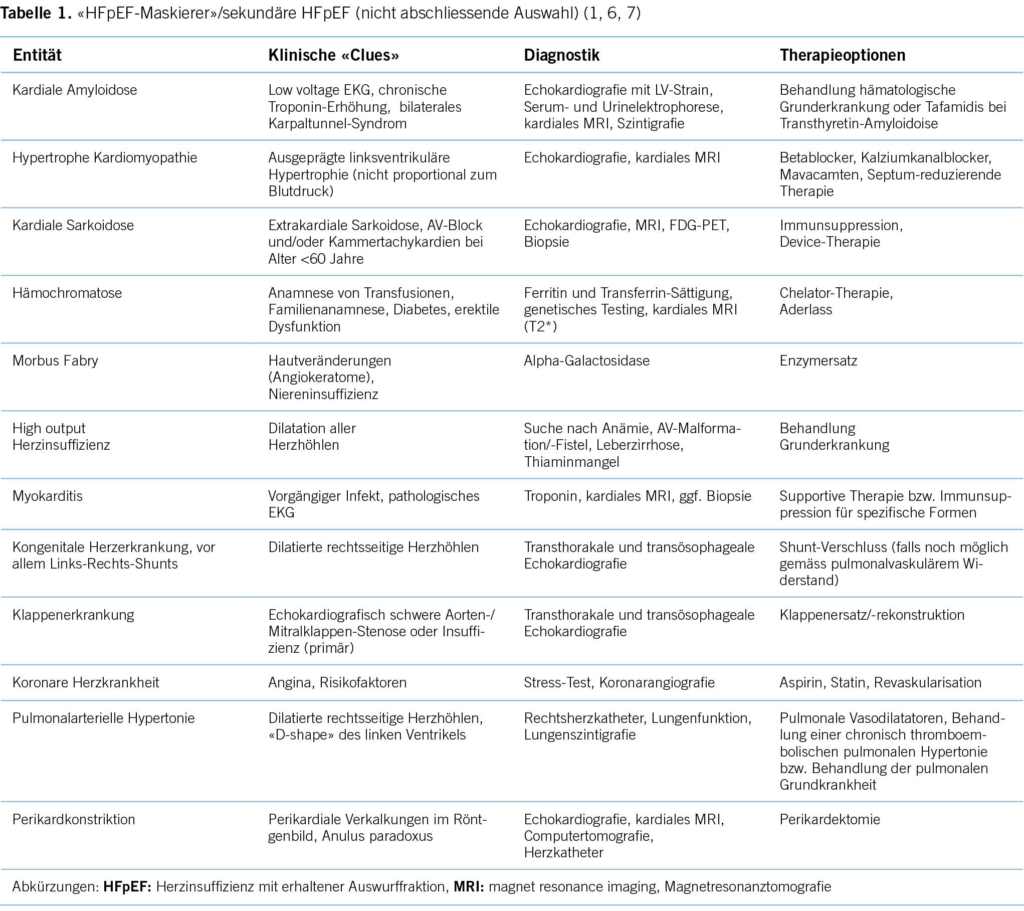
Eine «erhaltene» LVEF ist eine conditio sine qua non für die Diagnose von HFpEF, ist dafür aber nicht ausreichend. Gemäss den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) und der «universellen Definition» der Herzinsuffizienz ist HFpEF durch den LVEF-Bereich ≥50% charakterisiert und grenzt sich so von der Herzinsuffizienz mit leicht verminderter LVEF (heart failure with mildly reduced (früher: midrange) ejection fraction; HFmrEF; LVEF 41-49%) ab (2, 5). Die Entität HFmrEF wird in einem separaten Artikel in diesem Heft diskutiert. Wir gehen nur soweit darauf ein, wie es für das Verständnis der wesentlichen Aspekte von HFpEF erforderlich ist. Während bei Vorliegen von typischen Symptomen und fakultativ klinischen Zeichen (z. B. Lungenstauung, Ödeme) und Nachweis einer LVEF ≤40% oder 41-49% die Diagnose einer HFrEF bzw. HFmrEF definitiv gestellt werden kann, gilt dies für eine LVEF ≥50% nicht, da dieser LVEF-Bereich eigentlich normal ist (2). Zum einen müssen zusätzliche klinische, echokardiografische und/oder Biomarker-Kriterien erfüllt sein (siehe unten). Zum anderen müssen nicht kardiale Ursachen (z. B. Lungenerkrankung, Hyper-/Hypothyreose, Anämie) und spezifische kardiale Entitäten, welche mit erhaltener LVEF einhergehen können, aber nicht als HFpEF im engeren Sinne gelten, ausgeschlossen werden (Tabelle 1). Letztere werden aktuell entweder als «sekundäre HFpEF» (Europa) (6) oder «HFpEF-Maskierer»/«HFpEF-Mimics» (USA) (1, 7). bezeichnet. Unabhängig von der Terminologie existieren für diese Entitäten definierte Therapien. Entsprechend müssen diese Erkrankungen aktiv gesucht werden mittels definierter diagnostischer Pathways (Tabelle 1). Im klinischen Alltag werden etablierte HFpEF-Therapien (in erster Linie SGLT2i) in diesem Kontext mit dem Argument einer «HFpEF-Physiologie» eingesetzt (z. B. bei kardialer Amyloidose), was aber klar als off-label use angesehen werden muss. Im Zentrum der Diagnostik der HFpEF steht nach Ausschluss von den erwähnten spezifischen Ursachen dann der Nachweis einer linksventrikulären diastolischen Funktionsstörung und deren Konsequenzen. Als Goldstandard gilt aktuell der Rechtsherzkatheter mit Nachweis eines mittlerer PAWP (mPAWP) >15 mmHg in Ruhe und/oder >25 mmHg unter Belastung (1). Da diese invasive und aufwendige Untersuchung im Alltag nicht flächendeckend eingesetzt werden kann, existieren als Annäherung primär zwei nicht invasive Algorithmen, der europäische HFA-PEFF-Score (Abbildung 2) (8) und der amerikanische (Mayo) H2FPEF-Score (Abbildung 3) (9). Der HFA-PEFF-Score besteht aus verschiedenen echokardiografischen Parametern sowie zentral dem B-type natriuretic peptide (BNP) oder N-terminal-proBNP (NT-proBNP), wobei gemäss Major- und Minor-Kriterien ein Score von 0 bis 6 Punkten erreicht werden kann (Abbildung 2). Bei einem Score von ≥5 Punkten kann die Diagnose HFpEF gestellt werden, bei ≤1 Punkten ist diese unwahrscheinlich. Im Graubereich von 2-4 Punkten ist ein funktioneller Test notwendig, entweder eine diastolische Stress-Echokardiografie (gute Sensitivität, nicht spezifisch, zudem technisch anspruchsvoll) oder direkt ein Rechtsherzkatheter mit Belastung (8). Problematisch sind bei diesem Algorithmus das starke Gewicht des BNP/NT-proBNP bzw. die dafür vorgeschlagenen Grenzwerte. Es ist unterdessen gut dokumentiert, dass BNP und NT-proBNP bei HFpEF-Patientinnen und -Patienten im kompensierten Zustand relativ tief sein können, da die BNP-Produktion durch die linksventrikuläre Wandspannung determiniert ist, welche bei konzentrisch remodelierten Ventrikel (dicke Wand, kleiner Durchmesser) deutlich tiefer als bei HFrEF ist. Zudem führt die Adipositas zu tieferen BNP/NT-proBNP-Werten. Es wurde explizit nachgewiesen, dass übergewichtige HFpEF-Patienten, die die invasiv-hämodynamischen Kriterien einer HFpEF erfüllen, ein NT-proBNP <125 ng/l aufweisen können, was tiefer ist als das Minor-Kriterium des HFA-PEFF-Scores (10). Der HFA-PEFF-Score ist im Gegensatz zum H2FPEF-Score nicht gegen den invasiven Goldstandard validiert. Letzterer wurde in einer Kohorte von Patientinnen und Patienten ermittelt, welche sich infolge Belastungsdyspnoe einem Rechtsherzkatheter mit Belastung unterzogen (9). Ein weiterer Vorteil des H2FPEF-Scores ist dessen Einfachheit, indem wenige klinische und simple echokardiografische Parameter in einer simplen Art und Weise kombiniert werden (Abbildung 3). Die Wahrscheinlichkeit einer HFpEF verdoppelt sich mit jedem Score-Punkt. Auffallend ist die Tatsache, dass das NT-proBNP im Score nicht enthalten ist. Dies hat zum einen damit zu tun, dass bei einem Viertel der Testkohorte kein NT-proBNP gemessen wurde, aber auch die Limitation von nicht Body-Mass-Index-korrigierten NT-proBNP-Werten in der Population mit hoher Prävalenz von Adipositas (mittlerer BMI in dieser Kohorte: 33 kg/m2) spielt eine Rolle (9). Ein kürzlich publizierter Vergleich der beiden Scores in einer multizentrischen Kohorte hat klare Vorteile für den H2FPEF-Score gezeigt (vergleichbare Spezifität aber bessere Sensitivität als der HFA-PEFF-Score) (11). Im klinischen Alltag wird man eine detaillierte Echokardiografie durchführen und ein NT-proBNP messen und sich dann durch Berechnung beider Scores ein Bild verschaffen. In der Praxis wird man auch bei vielen Patientinnen und Patienten eine Koronarangiografie durchführen, da eine koronare Herzkrankheit wie oben ausgeführt eine wichtige Differentialdiagnose darstellt. In diesem Fall ist zu überlegen, ob bei intermediären Scores gleichzeitig ein Rechtsherzkatheter (in der Regel via brachialen Zugang möglich) erfolgen soll. Falls der mPAWP bereits in Ruhe erhöht ist (>15 mmHg), kann die Diagnose HFpEF gestellt werden. Falls dies nicht der Fall ist, müsste eine physikalische Belastung angeschlossen werden. Wenn dafür keine Infrastruktur/Expertise vorhanden ist, kann als Annäherung ein PAWP mit passivem Anheben der Beine gemessen werden. Es wurde kürzlich in einer kleinen Studie gezeigt, dass ein mPAWP ≥19 mmHg nach diesem Manöver 100% spezifisch für einen Anstieg des mPAWP auf >25 mmHg unter physikalischer Belastung ist (12). Im Zweifelsfall und falls dies überhaupt möglich ist (z.B. orthopädische oder koordinative Einschränkungen hinsichtlich Velofahren in Rückenlage), kann die Patientin oder der Patient einem spezialisierten Zentrum zugewiesen werden. Gleichzeitig müssen wir realisieren, dass in den klinischen Studien andere und unterschiedliche Einschlusskriterien angewendet wurden. Die beiden grossen positiven SGLT2i-Studien haben nur Patientinnen und Patienten mit NT-proBNP ≥300 ng/l (bei Vorhofflimmern: ≥600-900 ng/l) eingeschlossen, und dies sind streng genommen diejenigen, bei denen die Therapie nachgewiesenermassen effektiv ist.
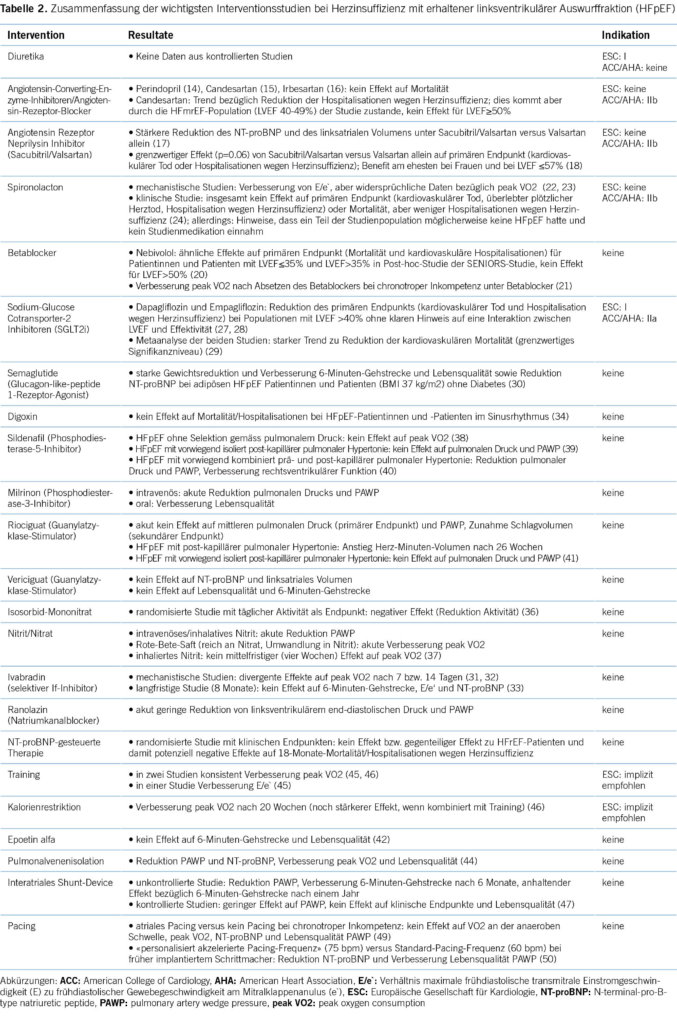
Therapie
Noch in den 2021 ESC-Leitlinien zur Diagnostik und Therapie der Herzinsuffizienz wurde festgehalten, dass keine Therapie existiert, welche Morbidität und Mortalität von Patientinnen und Patienten mit HFpEF verbessert (2). Durch die überzeugenden Daten zu den SGLT2i hat sich dies substanziell geändert, was auch ein Update der Leitlinien im Herbst 2023 bewirkte (13). Dies soll aber nicht darüber hinwegtäuschen, dass diverse andere Substanzen als Therapeutika bei HFpEF untersucht worden sind. Die Ergebnisse dieser Studien haben ebenfalls Implikationen für den klinischen Alltag, indem sie uns informieren, welche Substanzen bei HFpEF nicht gegeben werden sollen. Die wesentlichen Daten sind in Tabelle 2 zusammengefasst und werden nachfolgend diskutiert.
Diuretika
Weiterhin haben Diuretika in den 2021 ESC-Leitlinien (und Update 2023) eine Klasse-I-Empfehlung als symptomatische Therapie der HFpEF (einzige Klasse-I-Empfehlung neben SGLT2i und Suche nach und Behandlung von Komorbiditäten) (2, 13). Aufgrund der steilen end-diastolischen Druck-Volumen-Beziehung des kleinen und steifen linken Ventrikels ist ein Schleifendiuretikum symptomatisch bei HFpEF oft sehr effektiv. Gleichzeitig besteht aufgrund dieser Pathophysiologie die Gefahr der Überbehandlung mit Hypotonie und low output, sodass Diuretika in möglichst tiefer Dosierung und so kurz wie möglich eingesetzt werden sollen. Obschon es sich um eine Klasse-I-Indikation handelt, gibt es für Schleifendiuretika bei HFpEF keine Evidenz aus randomisierten Studien.
Angiotensin-Converting-Enzyme-Hemmer (ACE-Hemmer), Angiotensin-Rezeptor-Blocker und Angiotensin-Rezeptor-Neprilysin-Hemmer
Die Studien mit ACE-Hemmern und Angiotensin-Rezeptor-Blockern können dahingehend zusammengefasst werden, dass die untersuchten Substanzen Perindopril (14), Candesartan (15) und Irbesartan (16) Mortalität und Hospitalisationen bei HFpEF nicht reduzierten. Der günstige Effekt von Candesartan auf Hospitalisation in der CHARM-preserved (Candesartan versus Placebo) war durch die HFmrEF-Population der Studie erklärt (LVEF 40-49%; Einschlusskriterium für CHARM-preserved: LVEF >40%). In einer mechanistischen Studie ohne klinische Endpunkte führte der Angiotensin-Rezeptor-Neprilysin-Inhibitor Sacubtril/Valsartan bei HFpEF-Patientinnen und -Patienten (LVEF ≥45%) nach 12 Wochen zu einer stärkeren Reduktion des NT-proBNP und des linksatrialen Volumens im Vergleich zu Valsartan allein (17). Die randomisierte PARAGON-HF-Studie (Sacubitril/Valsartan versus Valsartan allein) fiel bezüglich des primären Endpunkts kardiovaskulärer Tod oder Hospitalisation wegen Herzinsuffizienz grenzwertig aus (p=0.06) und sorgte für kontroverse Diskussionen und unterschiedliche Interpretationen (18). Für diese Studie betrug der LVEF-Grenzwert für den Einschluss ebenfalls ≥45% (also nicht ≥50%), und es bestand ähnlich wie bei der CHARM-preserved-Studie eine Interaktion der LVEF mit dem Effekt des Verums, indem die Patientinnen und Patienten mit inframedianer LVEF (≤57%) profitierten. Ebenso profitierten Frauen eher als Männer. Da dies aber Resultate von Subgruppenanalysen sind, besteht für Sacubril/Valsartan gemäss ESC-Leitlinien keine Indikation für die Behandlung von HFpEF (wohl aber für HFmrEF) (2, 13). Gemäss US-Guidelines 2022 (19) bzw. einem US-Expertenkonsensus 2023 (7) ist Sacubitril/Valsartan für Frauen mit HFpEF und Männer mit HFpEF und «LVEF <55-60%» empfohlen (Klasse IIb). Ein Angiotensin-Rezeptor-Blocker (primär Candesartan) ist in den USA empfohlen (nicht gemäss ESC), wenn Sacubitril/Valsartan indiziert wäre, dieses aber wegen Unverträglichkeit/Kosten nicht infrage kommt (auch Klasse IIb).
Betablocker
Traditionell galt das Paradigma, dass Betablocker bei HFpEF durch Verlängerung der Diastolendauer eine günstige Wirkung haben («more time to relax»). Die entsprechende Datenlage bei HFpEF ist allerdings extrem bescheiden. Kleinere Studien waren neutral oder nicht konklusiv hinsichtlich Surrogat-Endpunkten wie diastolische Funktion oder Leistungsfähigkeit (6-Minuten-Gehtest, maximale Sauerstoffaufnahme (peak VO2)). Daten der SENIORS-Studie zeigten für Patientinnen und Patienten mit LVEF >35% ähnlich günstige Effekte (kombinierter Endpunkt Tod oder Hospitalisation aufgrund von kardiovaskulären Problemen) von Nebivolol gegenüber Placebo wie für diejenigen mit LVEF ≤35% (20). Die eigentliche HFpEF-Subpopulation in diese Subgruppe (LVEF ≥50%) war aber sehr klein, sodass keine verlässlichen Schlussfolgerungen bezüglich HFpEF abgeleitet werden können. Betablocker spielen wahrscheinlich primär eine Rolle bei HFpEF mit Vorhofflimmern zum Erreichen einer ausreichenden Herzfrequenzkontrolle. Andererseits gibt es zunehmend Hinweise, dass eine tiefe Herzfrequenz im Sinusrhythmus mit Einschränkung der chronotropen Kompetenz symptomatisch ungünstig ist, da bei einem nicht steigerbaren Schlagvolumen der cardiac output von der Herzfrequenz abhängt. In einer prospektiven Studie wurde gezeigt, dass Patientinnen und Patienten mit HFpEF, die unter Betablockertherapie eine chronotrope Inkompetenz aufweisen, die peak VO2 durch Absetzen des Betablockers signifikant verbessern konnten (21). Weder die ESC- noch die US-Leitlinien geben bezüglich Betablockern bei HFpEF eine Empfehlung ab.
Mineralokortikoid-Rezeptor-Antagonisten
Zwei mechanistische Studien haben konsistente Effekte des Mineralokortikoid-Rezeptor-Antagonisten Spironolacton auf die diastolische linksventrikuläre Funktion (E/e`) in Ruhe, aber divergente Resultate bezüglich peak VO2 ergeben (eine Studie neutral, eine positiv) (22, 23). Die randomisierte TOPCAT-Studie war bezüglich des primären kombinierten Endpunkts (kardiovaskulärer Tod, überlebter cardiac arrest, Hospitalisationen wegen Herzinsuffizienz) neutral, wobei die Hospitalisationen infolge Herzinsuffizienz allein durch Spironolacton (d. h. Komponente des primären Endpunkts) reduziert wurden (24). Diese Studie wird aufgrund von Post-hoc-Analysen diskrepant diskutiert und interpretiert. Auffallend waren eklatant unterschiedliche Ereignisraten und Therapieeffekte bei den in Nord-/Südamerika versus Georgien/Russland eingeschlossenen Patientinnen und Patienten, indem das in Nord-/Südamerika rekrutierte Kollektiv deutlich mehr Ereignisse hatte als die Population in Russland/Georgien und von Spironolacton profitierte (25). Messungen von Metaboliten von Spironolacton im Urin und der Verlauf des Kaliums unter Therapie und die erwähnten klinischen Daten suggerieren, dass ein relevanter Prozentsatz der in Russland/Georgien eingeschlossenen Patientinnen und Patienten keine HFpEF hatte (eher COPD; viel bessere Prognose als in Amerika) und kein Spironolacton einnahm (26). Somit ist diese Studie ein starkes Signal für einen günstigen Effekt von Spironolacton bei HFpEF. Die Leitlinien der ESC empfehlen Spironolacton aber trotzdem nicht (tun dies nur für HFmrEF aufgrund einer Post-hoc-Analyse, welche zeigte, dass Spironolacton in einer Analyse der Gesamtpopulation einen Effekt auf den primären Endpunkt im tiefsten Spektrum der LVEF von 45-50% hatte) (2, 13). Die 2022 US-Leitlinien (19) und ein US-Expertenkonsensus (7) aus dem Jahr 2023 empfehlen Spironolacton aber (Klasse IIb) für die Behandlung von HFpEF mit der gleichen Spezifizierung wie für Sacubitril/Valsartan (Frauen, Männer mit LVEF <55-60%).
SGLT2i
Die SGLT2i hemmen die Glucose- und Natrium-Rück-
resorption im proximalen Tubulus, führen so zu Glucosurie und Natriurese und wirken entsprechend leicht diuretisch. Sie haben aber auch direkte kardiale Effekte, deren genauen Mechanismen viel diskutiert, aber nicht im Detail bekannt sind. Es wird davon ausgegangen, dass es keine kardialen SGLT2-Rezeptoren gibt und metabolische Anpassungen für die kardialen Veränderungen verantwortlich sind. Nachdem für die beiden SGLT2i Dapagliflozin und Empagliflozin bei HFrEF unabhängig vom Vorliegen eines Diabetes überzeugende Ergebnisse bezüglich Morbidität und Mortalität gezeigt worden waren, folgten entsprechende Studien auch für HFpEF (und HFmrEF) (27, 28). Die EMPEROR-preserved (Empagliflozin versus Placebo) (27)- und DELIVER (Dapagliflozin versus Placebo) (28)-Studien haben praktisch deckungsgleiche Populationen eingeschlossen (jeweils LVEF >40%) und fast übereinstimmende Resultate ergeben. In beiden Studien führte der SGT2i zu einer signifikanten Reduktion des primären Endpunkts (relative Risikoreduktion ca. 20%) kardiovaskulärer Tod und Hospitalisation wegen Herzinsuffizienz,
wobei das Ergebnis durch die Hospitalisationen getrieben war und das Vorliegen eines Diabetes wie bei HFrEF keinen Einfluss auf die Effektivität des Verums hatte. Als Unterschiede zwischen den beiden Studien sind zu nennen, dass in DELIVER auch Patientinnen und Patienten mit auf >40% verbesserter LVEF (recovered LVEF) eingeschlossen wurden und dass in DELIVER keine Abschwächung des Effekts des SGLT2i mit steigender LVEF beobachtet wurde. Der letztere Effekt wurde in einer Metaanalyse aber als statistisch nicht bedeutsam beurteilt (29). In beiden Studien bestand separat kein signifikanter Effekt auf die kardiovaskuläre Mortalität, während dies in einer Metaanalyse der beiden Studien ein grenzwertiges Signifikanzniveau erreichte (29). Obschon die kardiovaskuläre Mortalität nicht ganz eindeutig reduziert wurde, haben die SGLT2i Empagliflozin und Dapagliflozin im 2023 Update der ESC-Leitlinien eine Klasse-I-Indikation für die Behandlung von HFpEF bekommen (13). Analog werden SGLT2i im US-Expertenkonsensus als primäre Therapie von Patientinnen und Patienten mit HFpEF empfohlen (7) (nicht in den US-Leitlinien (19), da zum Zeitpunkt der Publikation DELIVER noch nicht publiziert war). Die SGLT2i
haben grundsätzlich ein gutes Sicherheitsprofil, verursachen wenig Nebenwirkungen (primär genitale Infekte), haben nur einen minimen blutdrucksenkenden Effekt und sind so im Alltag einfach zu handhaben (fixe Dosierung von 10 mg für beide Substanzen, keine Titration nötig). Wichtig für die Vermeidung der seltenen Ketoazidose ist es, dass die Patientinnen und Patienten auf die sick-day rules hingewiesen werden. Dies heisst, dass der SGLT2i bei fehlender Nahrungs- und Flüssigkeitsaufnahme pausiert werden sollte.
Glucagon-like-peptide-1 (GLP-1)
Rezeptor Agonisten
Der GLP-1-Rezeptor-Agonist Semaglutid wurde kürzlich bei einer adipösen HFpEF-Population ohne Diabetes untersucht. Unter Semaglutid kam es zu einer ausgeprägten Gewichtsreduktion und Verbesserung der 6-Minuten-Gehstrecke und Lebensqualität im Vergleich zu Placebo (30). Gleichzeitig wurde unter Semaglutid das NT-proBNP reduziert, was bemerkenswert ist, da eine reine Gewichtsreduktion eigentlich zu einem Anstieg des NT-proBNP führt. Diese Beobachtung wird zusammen mit vielversprechenden präklinischen Daten als Hinweis für bedeutsame kardiale Effekte durch Semaglutid gewertet.
Ivabradin
Der selektive Inhibitor des If-Kanals des Sinusknotens wurde in mehreren HFpEF-Studien untersucht, um die Hypothese des Nutzens einer reinen Herzfrequenzreduktion (vgl. Betablocker) zu prüfen. Zwei mechanistische Studien haben aber widersprüchliche Ergebnisse hinsichtlich des Effekts einer kurzfristigen Therapie (Dauer 7 bzw. 14 Tage) mit Ivabradin auf die peak VO2 ergeben (31, 32). Die grössere (n=179) und über einen deutlich längeren Zeitraum (8 Monate) durchgeführte EDIFY-Studie zeigte keinen Effekt von Ivabradin (Zieldosis 2×7.5 mg) auf 6-Minuten-Gehstrecke, E/e‘ und NT-proBNP 33. Aktuell hat Ivabradin in den Leitlinien keine Indikation für die Behandlung von HFpEF.
Digoxin
In HFpEF-Stratum (LVEF >45%, alle Patienten im Sinusrhythmus) der DIG-Studie hatte Digoxin keinen Effekt auf Mortalität oder Hospitalisation wegen Herzinsuffizienz 34. Der Stellenwert von Digoxin bei HFpEF und Vorhofflimmern ist nicht definiert.
Kalziumkanalblocker
Theoretisch sind Kalziumkanalbocker vom Nicht-Dihydropyridin-Typ (Verapamil und Diltiazem) durch Verlängerung der Diastolendauer und lusitrope Effekte ideale Medikamente bei HFpEF. Die vorliegenden Daten sind diesbezüglich aber nicht konklusiv. Gemäss einer neuen Metaanalyse sind Kalziumkanalbocker vom Nicht-Dihydropyridin-Typ und vom Dihydropyridin-Typ (primär Amlodipin, Felodipin) bei HFpEF aber sicher (neutral hinsichtlich kardiovaskulärem Tod und Hospitalisation wegen Herzinsuffizienz) und können so zur Behandlung einer arteriellen Hypertonie bei diesen Patientinnen und Patienten eingesetzt werden (35).
Verbesserung der NO-Verfügbarkeit
Entsprechend der postulierten Pathophysiologie von HFpEF haben mehrere Studien das Prinzip einer Verbesserung der NO-Verfügbarkeit durch verschiedene medikamentöse Ansätze untersucht. Klassisches Isosorbid-Mononitrat führt im Vergleich zu Placebo zu einer Reduktion (statt Zunahme) der körperlichen Aktivität (36). Da eine chronische Nitrattherapie mit Toleranzentwicklung und/oder Hypotonie einhergeht, haben neuere Studien die Verabreichung von anorganischem Nitrit als NO-Quelle untersucht. Allerdings konnten die vielsprechenden akuten hämodynamischen Effekte (Reduktion PAWP unter Belastung) von intravenösem und inhaliertem anorganischen Nitrit in einer vierwöchigen Studie mit inhaliertem anorganischen Nitrit nicht bestätigt werden (keine Verbesserung peak VO2, NT-proBNP, E/e`, Grösse des linken Vorhofs) (37). Die Daten für den Phosphodiesterase-5-Hemmer Sildenafil sind ebenfalls nicht schlüssig. Bei unselektionierten Patientinnen und Patienten mit HFpEF (38) oder HFpEF mit rein post-kapillärer pulmonaler Hypertonie (39) hatte Sildenafil keinen Effekt auf die peak VO2 bzw. den pulmonalen Druck. Dies steht im Kontrast zu einer früheren Studie bei einem ausgewählten HFpEF-Kollektiv (pulmonale Hypertonie, meist kombiniert prä- und post-kapillär, alle mit Rechtsherzinsuffizienz), die eine hochsignifikante Reduktion von pulmonalem Druck und PAWP und eine Verbesserung der rechtsventrikulären Funktion gezeigt hatte (40). Für den zyklischen
Guanylzyklase-Stimulator Riociguat (zugelassen für die Behandlung der pulmonal-arteriellen Hypertonie) wurde in einer Dosisfindungsstudie (akuter Effekt einer Einzeldosis) keine Reduktion des pulmonalen Drucks, aber eine Zunahme des Schlagvolumens und in einer randomisierten Studie über 26 Wochen bei Patientinnen und Patienten mit HFpEF und post-kapillärer pulmonaler Hypertonie ein Anstieg des Herz-Minuten-Volumens nachgewiesen (41). Die verwandte Substanz Vericiguat hatte in zwei Studien keinen Effekt auf NT-proBNP, linksatriales Volumen und 6-Minuten-Gehstrecke und nicht konklusive Auswirkung auf die Lebensqualität. Für all diese Substanzen existieren bisher keine etablierten Indikationen bei Patientinnen und Patienten mit HFpEF.
Anämie/Eisenmangel
Die Rolle von Anämie und Eisenmangel bei HFpEF ist unklar. Die Gabe von Erythropoetin bei anämen Patientinnen und Patienten mit HFpEF führte zu einem Anstieg des Hämoglobins, resultierte im Vergleich zu Placebo aber nicht in einer Reduktion der linksventrikulären Masse oder einer Verbesserung der 6-Minuten-Gehstrecke oder der Lebensqualität (42). Während intravenöses Eisen (Eisen-Carbomaltose) bei HFrEF zumindest symptomatisch effektiv ist, liegen für HFpEF noch keine Daten vor.
Revaskularisation
Das Vorliegen einer koronaren Herzkrankheit ist bei HFpEF mit einer Verschlechterung der LVEF und einer erhöhten Mortalität assoziiert, und eine retrospektive Analyse suggeriert, dass eine komplette Revaskularisation diese Entwicklung verhindern kann (43). Im Gegensatz zu HFrEF liegen uns keinerlei Daten aus randomisierten Studien zum Effekt einer interventionellen oder chirurgischen Koronarrevaskularisation bei HFpEF vor. Die koronare Herzkrankheit soll gemäss aktuellen Leitlinien basierend auf Symptomen, Ausmass einer Ischämie und anatomischer Komplexität primär unabhängig von der HFpEF behandelt werden. Erst nach adäquater Therapie der koronaren Herzkrankheit wird es klar sein, ob noch eine HFpEF im engeren Sinn vorliegt.
Management des Vorhofflimmerns
Das Vorliegen eines Vorhofflimmerns ist bei HFpEF mit einem besonders ungünstigen hämodynamischen Profil assoziiert. Wie bei HFrEF geht man von einer teufelskreisartigen Interaktion zwischen Herzinsuffizienz und Vorhofflimmern aus. Eine kleine randomisierte Studie hat nun sehr eindrückliche Effekte einer Pulmonalvenenisolation auf Hämodynamik, NT-proBNP, peak VO2 und Lebensqualität nachgewiesen 44. Auch wenn die Datenlage noch zu knapp ist für eine Leitlinienempfehlung, muss man sich im Alltag bei allen Patientinnen und Patienten mit Vorhofflimmern neben der Etablierung und Erhaltung einer oralen Antikoagulation fragen, inwieweit eine Rhythmuskontrolle realistisch und sinnvoll ist.
Training
Wie in anderen Settings können Patienten mit HFpEF durch körperliches Training ihre Leistungsfähigkeit verbessern, wobei dies auch mit Verbesserung der diastolischen linksventrikulären Funktion (E/e`, Grösse des linken Vorhofs) einhergeht (45, 46). Entsprechend sollte Training/Rehabilitation immer Teil des Behandlungskonzepts bei HFpEF sein.
Interatriales Shunt-Device
Die Kreation eines Vorhofseptumdefekts durch ein perkutan implantierbares Device (Durchmesser 8 mm) mit der Idee einer Dekompression des linken Vorhofs hat in einer unkontrollierten Studie zu einer Reduktion des Anstiegs des PAWP unter Belastung und Verbesserung der Leistungsfähigkeit bei HFpEF-Patientinnen und -Patienten geführt (Follow-up ein Jahr). Eine kleine mittels Sham-Prozedur kontrollierte Studie hat eine signifikante Reduktion des PAWP unter Belastung bestätigt. In einer grösseren randomisierten, ebenfalls mittels Sham-Prozedur kontrollierten Studie konnten aber keine relevanten Effekte auf klinische Endpunkte beobachtet werden (47). Eine Post-hoc-Analyse kam zum Schluss, dass Patientinnen und Patienten ohne «latente pulmonalvaskuläre Erkrankung» (pulmonalvaskulärer Widerstand <1.74 WU) profitieren könnten, während sich diejenigen mit latenter pulmonalvaskulärer Erkrankung verschlechtern könnten (48).
Weitere Devices
In einer kleinen randomisierten Cross-over-Studie an 32 Patienten bewirkte rechtsatriales Pacing (de novo implantation eines Schrittmachers) bei chronotroper Inkompentenz keine verbesserte Leistungsfähigkeit gemessen am peak VO2 (49). Hingegen scheint eine individuelle Anpassung der Grundfrequenz über 60 bpm bei Patientinnen und Patienten mit HFpEF und bereits vorgängig implantiertem Schrittmacher (57% Sick Sinus Syndrom, 43% AV-Block) unter möglichst guter Reduktion von RV-Pacing eine Verbesserung der Leistungsfähigkeit zu bringen (50). Für die kardiale Resynchronisationstherapie bei HFpEF liegen keine Daten vor. Klappeneingriffe sind bei HFpEF ebenfalls nicht etabliert, und obschon eine funktionelle Mitral- und/oder Trikuspidalinsuffizienz (in der Regel «atriale» Insuffizienz) pathophysiologisch eine Rolle spielen kann, müssen alle Interventionen in diesem Kontext bei HFpEF vorderhand als experimentell angesehen und auch so deklariert werden. Aktuell sind verschiedene Device-Studien bei HFpEF im Gange, deren Resultate in den nächsten Jahren erwartet werden.
Vorgehen in der Praxis
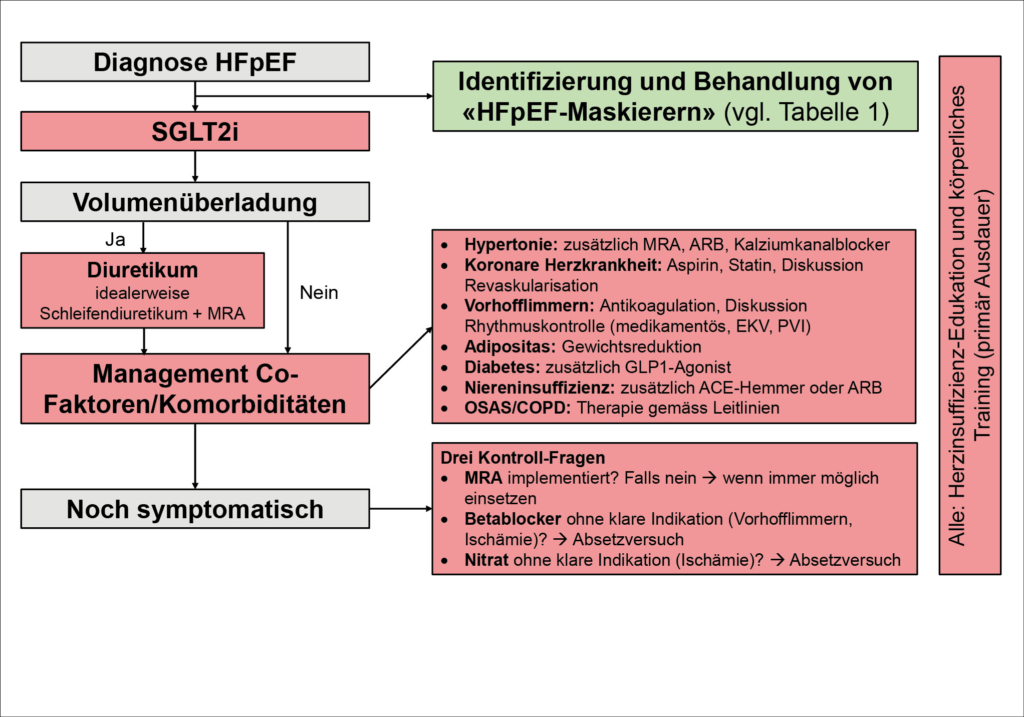
Ein möglicher Ansatz für das therapeutische Vorgehen in der Praxis ist in Abbildung 4 dargestellt. Dabei handelt es sich um eine modifizierte Form eines Vorschlags einer US- Expertengruppe (1). Die hauptsächliche Modifikation ist das Weglassen von Sacubril/Valsartan aus dem Algorithmus, da das Medikament wie oben diskutiert in den ESC-Leitlinien nicht empfohlen ist und in der Schweiz für die Behandlung von HFpEF auch nicht zugelassen ist und nicht vergütet wird. Spironolacton wurde im Algorithmus belassen, obschon das Medikament in den ESC-Leitlinien ebenfalls nicht empfohlen wird. Es handelt sich aber um ein kostengünstiges Medikament, welches auch zur Behandlung einer Hypertonie und/oder Hypokaliämie eingesetzt werden kann, sodass ein Einsatz bei HFpEF meist nicht mit fehlender Kostenübernahme sanktioniert werden dürfte. Wie bereits diskutiert, wird die Behandlung gemäss kardiovaskuläre Ko-Faktoren und Komorbiditäten individualisiert. Essentiell ist auch die Patientenedukation und Schulung des Selbstmanagements (z. B. Diuretika).
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Literatur:
Aus Platzgründen ist die Anzahl Referenzen begrenzt. Entsprechend sind einige Angaben im Text ohne Literaturzitat. Weitere Literaturangaben können bei Bedarf beim Korrespondenzautor bezogen werden.
1. Borlaug BA, Sharma K, Shah SJ, Ho JE. Heart Failure With Preserved Ejection Fraction: JACC Scientific Statement, J Am Coll Cardiol. 2023;81:1810-34.
2. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42:3599-726.
3. Maeder MT, Thompson BR, Brunner-La Rocca HP, Kaye DM. Hemodynamic basis of exercise limitation in patients with heart failure and normal ejection fraction, J Am Coll Cardiol 2010;56:855-63.
4. Paulus WJ, Tschope C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation, J Am Coll Cardiol 2013;62:263-71.
5. Bozkurt B, Coats AJS, Tsutsui H, Abdelhamid CM, Adamopoulos S, Albert N, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure: Endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association, Eur J Heart Fail 2021;23:352-80.
6. Anker SD, Usman MS, Anker MS, Butler J, Bohm M, Abraham WT, et al. Patient phenotype profiling in heart failure with preserved ejection fraction to guide therapeutic decision making. A scientific statement of the Heart Failure Association, the European Heart Rhythm Association of the European Society of Cardiology, and the European Society of Hypertension. Eur J Heart Fail 2023;25:936-55.
7. Kittleson MM, Panjrath GS, Amancherla K, Davis LL, Deswal A, Dixon DL, et al. 2023 ACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee, J Am Coll Cardiol 2023;81:1835-78.
8. Pieske B, Tschope C, de Boer RA, Fraser AG, Anker SD, Donal E, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC), Eur Heart J 2019;40:3297-3317.
9. Reddy YNV, Carter RE, Obokata M, Redfield MM, Borlaug BA. A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation 2018;138:861-870.
10. Verbrugge FH, Omote K, Reddy YNV, Sorimachi H, Obokata M, Borlaug BA. Heart failure with preserved ejection fraction in patients with normal natriuretic peptide levels is associated with increased morbidity and mortality. Eur Heart J 2022;43:1941-51.
11. Reddy YNV, Kaye DM, Handoko ML, van de Bovenkamp AA, Tedford RJ, Keck C, et al, Diagnosis of Heart Failure With Preserved Ejection Fraction Among Patients With Unexplained Dyspnea. JAMA Cardiol 2022;7:891-899.
12. van de Bovenkamp AA, Wijkstra N, Oosterveer FPT, Vonk Noordegraaf A, Bogaard HJ, van Rossum AC, et al. The Value of Passive Leg Raise During Right Heart Catheterization in Diagnosing Heart Failure With Preserved Ejection Fraction. Circ Heart Fail 2022;15:e008935.
13. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023:44:3627-39.
14. Cleland JG, Tendera M, Adamus J, Freemantle N, Polonski L. Taylor J, et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study, Eur Heart J 2006:27:2338-45.
15. Yusuf S, Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJ, et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003:362:777-81.
16. Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, et al. Irbesartan in patients with heart failure and preserved ejection fraction, N Engl J Med 2008:359:2456-67.
17. Solomon SD, Zile M, Pieske B, Voors A, Shah A, Kraigher-Krainer E, et al. Prospective comparison of The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet 2012:380:1387-95.
18. Solomon SD, McMurray JJV, Anand IS, Ge J, Lam CSP, Maggioni AP, et al.Angiotensin-Neprilysin Inhibition in Heart Failure with Preserved Ejection Fraction, N Engl J Med 2019;381:1609-1620.
19. Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines, Circulation 2022;145:e876-e894.
20. van Veldhuisen DJ, Cohen-Solal A, Bohm M, Anker SD, Babalis D, et al. Beta-blockade with nebivolol in elderly heart failure patients with impaired and preserved left ventricular ejection fraction: Data From SENIORS (Study of Effects of Nebivolol Intervention on Outcomes and Rehospitalization in Seniors With Heart Failure). J Am Coll Cardiol 2009;53:2150-8.
21. Palau P, Seller J, Dominguez E, Sastre C, Ramon JM, de La Espriella R, et al. Effect of beta-Blocker Withdrawal on Functional Capacity in Heart Failure and Preserved Ejection Fraction. J Am Coll Cardiol 2021:78:2042-56.
22. Kosmala W, Rojek A, Przewlocka-Kosmala M, Wright L, Mysiak A, Marwick T. Effect of Aldosterone Antagonism on Exercise Tolerance in Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol 2016:68:1823-34.
23. Edelmann F, Wachter R, Schmidt AG, Kraigher-Krainer E, Colantonio C, Kamke W, et al. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the Aldo-DHF randomized controlled trial. JAMA 2013:309:781-91.
24. Pitt B, Pfeffer MA, Assmann SF, Boineau R, Anand IS, Claggett B, et al. Spironolactone for heart failure with preserved ejection fraction. N Engl J Med 2014;370:1383-92.
25. Pfeffer MA, Claggett B, Assmann SF, Boineau R, Anand IS, Clausell N, et al. Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist (TOPCAT) trial. Circulation 2015;131:34-42.
26. de Denus S, O‘Meara E, Desai AS, Claggett B, Lewis EF, Leclair G, et al. Spironolactone Metabolites in TOPCAT – New Insights into Regional Variation. N Engl J Med 2017;376:1690-2.
27. Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Bohm M, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021;385:1451-61.
28. Solomon SD, McMurray JJV, Claggett B, de Boer RA, DeMets D, Hernandez AF, et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022:387:1089-98.
29. Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernandez AF, et al. SGLT-2 inhibitors in patients with heart failure: a comprehensive meta-analysis of five randomised controlled trials. Lancet 2022;400:757-67.
30. Kosiborod MN, Abildstrom SZ, Borlaug BA, Butler J, Rasmussen S, Davies M, et al. Semaglutide in Patients with Heart Failure with Preserved Ejection Fraction and Obesity, N Engl J Med 2023;389:1069-84.
31. Kosmala W, Holland DJ, Rojek A, Wright L, Przewlocka-Kosmala M, Marwick TH. Effect of If-channel inhibition on hemodynamic status and exercise tolerance in heart failure with preserved ejection fraction: a randomized trial. J Am Coll Cardiol 2013;62:1330-8.
32. Pal N, Sivaswamy N, Mahmod M, Yavari A, Rudd A, Singh S, et al. Effect of Selective Heart Rate Slowing in Heart Failure With Preserved Ejection Fraction. Circulation 2015;132:1719-25.
33. Komajda M, Isnard R, Cohen-Solal A, Metra M, Pieske B, Ponikowski P, et al. Effect of ivabradine in patients with heart failure with preserved ejection fraction: the EDIFY randomized placebo-controlled trial, Eur J Heart Fail 2017;19:1495-1503.
34. Digitalis Investigator. The effect of digoxin on mortality and morbidity in patients with heart failure, N Engl J Med 1997;336:525-33.
35. Matsumoto S, Kondo T, Yang M, Campbell RT, Docherty KF, de Boer RA, et al. Calcium channel blocker use and outcomes in patients with heart failure and mildly reduced and preserved ejection fraction. Eur J Heart Fail 2023;25:2202-14.
36. Redfield MM, Anstrom KJ, Levine JA, Koepp GA, Borlaug BA, Chen HH, et al. Isosorbide Mononitrate in Heart Failure with Preserved Ejection Fraction. N Engl J Med 2015;373:314-24.
37. Borlaug BA, Anstrom KJ, Lewis GD, Shah SJ, Levine JA, Koepp GA, et al. Effect of Inorganic Nitrite vs Placebo on Exercise Capacity Among Patients With Heart Failure With Preserved Ejection Fraction: The INDIE-HFpEF Randomized Clinical Trial. JAMA 2018;320:1764-73.
38. Redfield MM, Chen HH, Borlaug BA, Semigran MJ, Lee KL, Lewis G, et al. Effect of phosphodiesterase-5 inhibition on exercise capacity and clinical status in heart failure with preserved ejection fraction: a randomized clinical trial. JAMA 2013:309:1268-77.
39. Hoendermis ES, Liu LC, Hummel YM, van der Meer P, de Boer RA, Berger RM, et al. Effects of sildenafil on invasive haemodynamics and exercise capacity in heart failure patients with preserved ejection fraction and pulmonary hypertension: a randomized controlled trial. Eur Heart J 2015;36:2565-73.
40. Guazzi M, Vicenzi M, Arena R, Guazzi MD. Pulmonary hypertension in heart failure with preserved ejection fraction: a target of phosphodiesterase-5 inhibition in a 1-year study. Circulation 2011;124:164-74.
41. Dachs TM, Duca F, Rettl R, Binder-Rodriguez C, Dalos D, Ligios LC, et al. Riociguat in pulmonary hypertension and heart failure with preserved ejection fraction: the haemoDYNAMIC trial. Eur Heart J 2022;43:3402-3413.
42. Maurer MS, Teruya S, Chakraborty B, Helmke S, Mancini D. Treating anemia in older adults with heart failure with a preserved ejection fraction with epoetin alfa: single-blind randomized clinical trial of safety and efficacy. Circ Heart Fail 2013;6:254-63.
43. Hwang SJ, Melenovsky V, Borlaug BA. Implications of coronary artery disease in heart failure with preserved ejection fraction. J Am Coll Cardiol 2014:63:2817-27.
44. Chieng D, Sugumar H, Segan L, Tan C, Vizi D, Nanayakkara S, et al. Atrial Fibrillation Ablation for Heart Failure With Preserved Ejection Fraction: A Randomized Controlled Trial. JACC Heart Fail 2023:11:646-58.
45. Edelmann F, Gelbrich G, Dungen HD, Frohling S, Wachter R, Stahrenberg R, et al. Exercise training improves exercise capacity and diastolic function in patients with heart failure with preserved ejection fraction: results of the Ex-DHF (Exercise training in Diastolic Heart Failure) pilot study. J Am Coll Cardiol 2011;58:1780-91.
46. Kitzman DW, Brubaker P, Morgan T, Haykowsky M, Hundley G, Kraus WE, et al. Effect of Caloric Restriction or Aerobic Exercise Training on Peak Oxygen Consumption and Quality of Life in Obese Older Patients With Heart Failure With Preserved Ejection Fraction: A Randomized Clinical Trial. JAMA 2016;315:36-46.
47. Shah SJ, Borlaug BA, Chung ES, Cutlip DE, Debonnaire P, Fail PS, et al. Atrial shunt device for heart failure with preserved and mildly reduced ejection fraction (REDUCE LAP-HF II): a randomised, multicentre, blinded, sham-controlled trial. Lancet 2022;399:1130-40.
48. Borlaug BA, Blair J, Bergmann MW, Bugger H, Burkhoff D, Bruch L, et al. Latent Pulmonary Vascular Disease May Alter the Response to Therapeutic Atrial Shunt Device in Heart Failure, Circulation 2022;145;1592-1604.
49. Reddy YNV, Koepp KE, Carter R, Win S, Jain CC, Olson TP, et al. Rate-Adaptive Atrial Pacing for Heart Failure With Preserved Ejection Fraction: The RAPID-HF Randomized Clinical Trial. JAMA 2023;329:801-9-
50. Infeld M, Wahlberg K, Cicero J, Plante TB, Meagher S, Novelli A, et al. Effect of Personalized Accelerated Pacing on Quality of Life, Physical Activity, and Atrial Fibrillation in Patients With Preclinical and Overt Heart Failure With Preserved Ejection Fraction: The myPACE Randomized Clinical Trial. JAMA Cardiol 2023;8:213-21.
Therapeutische Umschau
- Vol. 81
- Ausgabe 2
- April 2024