- Interventionelle Psychiatrie und neuartige Substanzen zur Behandlung affektiver Störungen
Neue Entwicklungen in der Behandlung affektiver Störungen
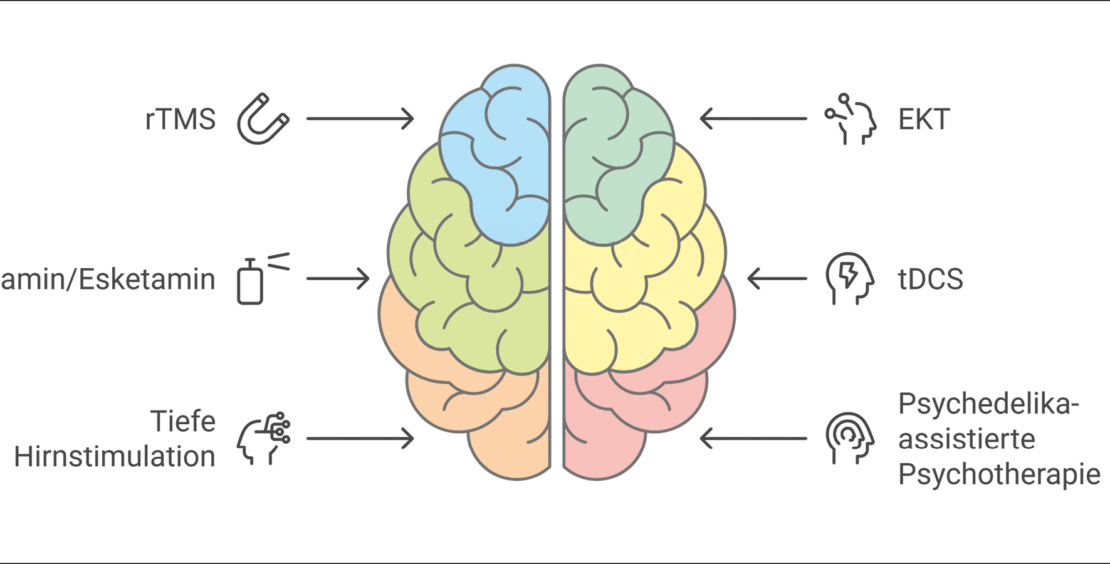
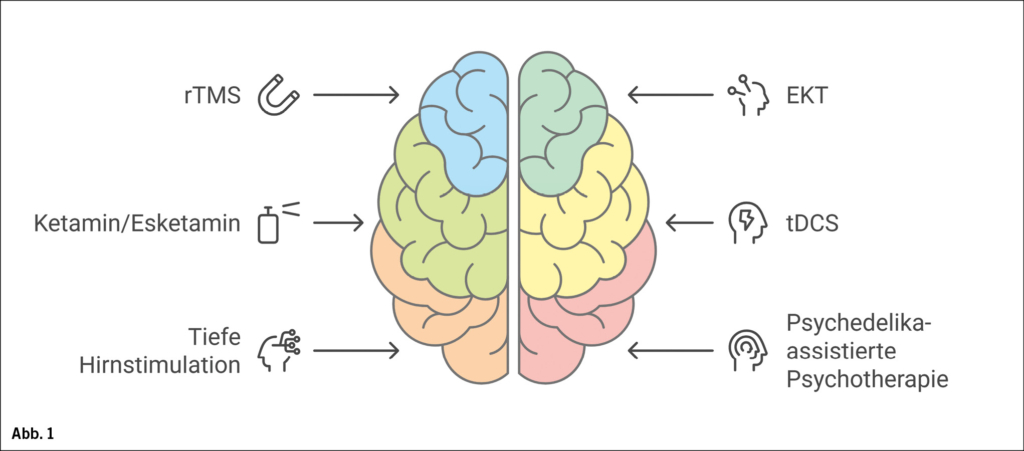
Depressionen gehören zu den affektiven Störungen und sind durch die Kernsymptome niedergedrückte Stimmung, Freudlosigkeit und Antriebsmangel gekennzeichnet. Die Wahrscheinlichkeit, im Laufe des Lebens mindestens einmal an einer depressiven Episode zu erkranken, liegt bei 16–20 % (1). Damit gehören Depressionen zu den häufigsten psychischen Erkrankungen. Depressionen werden mit Psychotherapie oder Antidepressiva und bei mittelschwerer und schwerer Ausprägung mit Kombination von Antidepressiva und Psychotherapie behandelt. Pharmakologische und psychotherapeutische Behandlungen sind effiziente Verfahren zur Behandlung von Depressionen. Die Wahrscheinlichkeit, auf eine Behandlung mit einem Antidepressivum anzusprechen und eine Remission zu erreichen, liegt während einer depressiven Episode bei einem ersten Behandlungsversuch bei 36 % und fällt bei einem zweiten Versuch auf 30 %, während bei einem dritten oder vierten Behandlungsversuch nur noch 13 % der Patientinnen und Patienten mit Depression ansprechen (2). Unter dem Begriff der Therapieresistenz wird in der Regel ein fehlendes Ansprechen auf mindestens zwei Antidepressiva, die in hinreichender Dosis und Dauer eingenommen wurden, verstanden (3). Abzugrenzen ist die Pseudotherapieresistenz; eine scheinbare Resistenz, die u. a. durch Fehldiagnosen, nicht erkannte psychiatrische Komorbiditäten, somatische Begleiterkrankungen, fehlende Therapie-Compliance oder insuffiziente Medikamentenspiegel bedingt ist. Der Begriff der «Therapieresistenz» geht jedoch mit einer negativen, pessimistischen Konnotation einher. Zudem ist die Implikation, dass nicht geholfen werden kann, inhaltlich nicht gerechtfertigt, da es neue Entwicklungen und innovative Behandlungsmethoden gibt. Daher wird das Konzept der schwer behandelbaren Depression in der letzten Zeit bevorzugt. Der Bereich der interventionellen Psychiatrie umfasst innovative und wirksame Hirnstimulationsverfahren, die die pharmakologische und psychotherapeutische Standardtherapie ergänzen. Im Folgenden soll eine Übersicht über verschiedene Verfahren der interventionellen Psychiatrie und neuartige Substanzen gegeben werden (Abb. 1).
Repetitive transkranielle Magnetstimulation
Bei der repetitiven transkraniellen Magnetstimulation TMS (rTMS) wird das Prinzip der elektromagnetischen Induktion genutzt, um gezielt spezifische Hirnareale zu aktivieren oder zu hemmen und damit Netzwerke zu beeinflussen. In Abhängigkeit von der Frequenz der applizierten Pulse kann dies zu einer Langzeitpotenzierung oder Langzeitdepression der stimulations- und schädelnahen Hirnrinde führen. Das bedeutet, dass die Wahrscheinlichkeit für das Auslösen eines axonalen Aktionspotenzials erhöht (Langzeitpotenzierung) oder erniedrigt (Langzeitdepression) wird (4). Die rTMS zielt darauf ab, Veränderungen von Hirndurchblutung und Aktivität, welche mit neuropsychiatrischen Erkrankungen in Verbindung gebracht werden, zu normalisieren. Bei depressiven Erkrankungen geht man von einer Unteraktivierung des linken dorsolateralen präfrontalen Kortex (dlPFK) aus, die mit Schweregrad der Symptome wie Antriebslosigkeit korreliert (5). Dementsprechend werden meistens stimulierende Protokolle über dem linken dlPFK verwendet. Seltener wird der rechte dlPFK gehemmt oder ein alternativer Stimulationsort (z. B. orbitofrontaler Kortex) gewählt. Die Geschwindigkeit von technischen Entwicklungen ist in diesem Bereich aktuell sehr hoch. Neben verschiedenen Ansätzen zur Optimierung des idealen Stimulationsortes (z. B. mittels anatomisch gesteuerter Navigation oder basierend auf funktioneller MRT-Bildgebung) kommen zunehmend intensivierte bzw. beschleunigte («accelerated» rTMS) Protokolle zum Einsatz. Beschleunigte Protokolle applizieren eine höhere Anzahl von Pulsen in einer kürzeren Zeit als konventionelle rTMS-Stimulationsprotokolle. Besondere Aufmerksamkeit hat das in Stanford entwickelte Stanford Accelerated Intelligent Neuromodulation Treatment (SAINT) Protokoll hervorgerufen, das 10-mal/Tag für 10 Minuten appliziert wird und bei Patientinnen und Patienten mit Therapieresistenz in Studien innerhalb von 5 Tagen Remissionsraten von über 90 % erreichen konnte (6). Die rTMS-Behandlung ist in der Regel gut verträglich. Kopfschmerzen oder transiente Missempfindungen am Stimulationsort können auftreten. Epileptische Anfälle sind sehr selten beschrieben (7), weswegen vor Beginn der Behandlung ein EEG zum Ausschluss einer erhöhten Anfallsneigung durchgeführt werden sollte. Erste randomisierte kontrollierte Studien bei Patientinnen und Patienten, die nicht auf einen antidepressiv pharmakologischen Behandlungsversuch ansprachen, zeigten die Überlegenheit einer rTMS-Behandlung im Vergleich mit einem Wechsel des Antidepressivums oder einer Augmentation (8, 9). Klinische Stratifizierung von Subgruppen mit besserem Ansprechen und das Nutzen von EEG und bildgebenden Verfahren könnten die Wirksamkeit der rTMS noch deutlich weiter erhöhen (10).
Elektrokonvulsionstherapie
Die Elektrokonvulsionstherapie (EKT) gehört zu den wirksamsten Behandlungsmethoden depressiver Erkrankungen und wird zudem bei schwer behandelbaren psychotischen und katatonen Syndromen angewandt. In Kurznarkose und Muskelrelaxation wird mittels elektrischer Stimulation (kurze bis ultrakurze unipolare Rechteckimpulse) nach erfolgter Präoxygenierung ein kurzer (Dauer optimal 30–60 Sekunden), kontrollierter, generalisierter epileptischer Anfall ausgelöst. Der generalisierte epileptische Anfall wird mittels Elektroenzephalographie (EEG) dokumentiert und quantifiziert. Die EKT zeigt bei Patientinnen und Patienten mit schwer zu behandelnder Depression («Therapieresistenz») Ansprech- und Remissionsraten von über 60 % und ist damit bei dieser Subgruppe wirksamer als Pharmakotherapie (11). Für die EKT gibt es gut belegte klinische Prädiktoren für ein therapeutisches Ansprechen (hohes Alter, Depression mit psychotischen Symptomen, psychomotorische Verlangsamung, katatone Symptome) (12). Exzellente Ansprechraten zeigen sich vor allem bei Patientinnen und Patienten mit psychotischer und mit katatoner bzw. stuporöser Symptomatik, welche auch bei schwer ausgeprägten depressiven Erkrankungen auftreten kann. Hier liegen Remissionsraten bei über 90 %. Im Falle der lebensbedrohlichen perniziösen Katatonie, die auf eine medikamentöse Behandlung häufig nur unzureichend anspricht, ist die EKT die Methode der Wahl (13). Die EKT ist ein sicheres Verfahren. Auftretende Nebenwirkungen sind Kurzzeitgedächtnisstörungen (Schwierigkeiten beim Abspeichern neuer Informationen während des Zeitraums der EKT-Behandlung), kurzdauernde Kopfschmerzen und Übelkeit am Behandlungstag, die gut symptomatisch behandelbar sind. Die EKT ruft eine Reihe von neuroplastischen Veränderungen hervor. Besonders gut belegt sind transiente Vergrösserungen der Hippocampi und der kortikalen Dicke insbesondere im cingulären und präfrontalen Cortex. Ob diese Veränderungen einen (kausalen) Zusammenhang mit klinischer Verbesserung haben, ist allerdings umstritten; ein linearer Zusammenhang ist gemäss dem aktuellen wissenschaftlichen Stand eher unwahrscheinlich (14, 15). Grosse internationale Konsortien untersuchen gegenwärtig Neuroplastizität und prädiktive Marker für ein EKT-Ansprechen basierend auf EEG und MRT-Analysen (15, 16). Selbst mit sehr sensitiven Methoden lassen sich keine neuronalen Schädigungen durch die EKT nachweisen.
Transkranielle Gleichstromstimulation
Bei der transkraniellen Gleichstromstimulation (englisch: transcranial direct current stimulation, tDCS) wird im Gegensatz zur rTMS kein Aktionspotenzial ausgelöst, sondern eine Verschiebung des Ruhemembranpotenzials hervorgerufen. Zur Behandlung depressiver Symptome werden Klebeelektroden meist über dem linken (Anode) und dem rechten (Kathode) dlPFK angebracht. Elektronen fliessen von der Anode zur Kathode. Hierdurch kommt es zu einer Depolarisation im Bereich des linken dlPFK, was die Wahrscheinlichkeit für das Auftreten eines Aktionspotenzials erhöht. Klinisch randomisierte kontrollierte Studien zeigen einen Effekt der tDCS im Vergleich zu einer Scheinstimulation (17). Vergleichsstudien der tDCS mit einer Behandlung mit selektiven Serotonin-Wiederaufnahmehemmern (SSRI) deuten aber eher auf eine unterlegene Wirksamkeit der tDCS-Behandlung im Vergleich zu einer Behandlung mit SSRI hin (18). Die Behandlung mit tDCS ist sicher, Nebenwirkungen wie beispielsweise Hautirritationen und Erytheme sind in der Regel mild und treten selten auf (19). Zwei grosse randomisiere kontrollierte, multizentrische Studien, die die Kombination von tDCS mit Pharmakotherapie bzw. Psychotherapie untersuchten, konnten keine Überlegenheit der tDCS-Gruppe nachweisen (20, 21). Am ehesten geeignet erscheint die tDCS-Behandlung für Patientinnen und Patienten mit leicht ausgeprägtem Schweregrad, die eine Behandlung mit Hirnstimulationsverfahren wünschen. Ein Vorteil der Behandlung mit tDCS (im Vergleich zur rTMS) ist die Möglichkeit, die Behandlung zu Hause durchzuführen (17). Eine vor Kurzem publizierte Studie zeigte, dass eine tDCS-Behandlung, die unmittelbar vor einer Behandlung mit rTMS durchgeführt wurde, die antidepressive Wirksamkeit der rTMS-Behandlung signifikant verbesserte (22). Auch die Wirksamkeit der tDCS als Erhaltungstherapie wird gegenwärtig untersucht (23). Trotz interessanter und vielversprechender Studienergebnisse konnte die Evidenz von tDCS zur Behandlung von Depressionen noch nicht hinreichend belegt werden und ist deswegen gegenwärtig als experimentelle Behandlungsmethode einzustufen.
Esketamin und Ketamin
Intranasal appliziertes Esketamin (S-Enantiomer von Ketamin) und intravenös verabreichtes Ketamin (Racemat von S- und R-Enantiomer) stellen für die Indikation der Behandlung der therapieresistenten Depression relativ neue Substanzen dar. Die Behandlung mit intranasalem Esketamin wurde 2019 sowohl von der Food and Drug Administration (FDA) als auch von der European Medicines Agency (EMA) zugelassen. Die Zulassung wurde 2020 für Patientinnen und Patienten mit Depression und akuter Suizidalität erweitert. Die Behandlung mit intranasalem Esketamin erfolgt in Kombination mit einem Antidepressivum. Die Wirksamkeit und vor allem der im Vergleich zur Behandlung mit Antidepressiva sehr schnelle antidepressive Wirkeintritt nach Stunden bis Tagen konnte in zahlreichen Studien belegt werden (24, 25). Der Hauptwirkmechanismus der Esketaminbehandlung erfolgt durch die antagonistische Affinität an N-Methyl-D-Aspartat(NMDA)-Rezeptoren. Durch eine Antagonisierung von γ-aminobutyric-acid(GABA)-Interneuronen erfolgt eine erhöhte synaptische Glutamatausschüttung. Glutamat aktiviert unter anderem den ionotropen AMPA-Rezeptor, der eine Kaskade in Bewegung setzt, die zu einer Erhöhung des brain-derived neurotrophic factor (BDNF) führt, was eine verstärkte Neurogenese, unter anderem im Hippocampus und dem medialen präfrontalen Cortex, initiiert (24). Valide Kritikpunkte bezüglich der gegenwärtigen Studienlage sind Schwierigkeiten der Verblindung (Euphorie, Dissoziation bei Verumgabe) und Erwartungseffekte selektierter Patienten, was zu überhöhten Effektstärken führen kann. Zu den Nebenwirkungen gehören Dissoziation, Induktion von Ängsten, Sedation, Schwindel, Blutdruck- und Pulsentgleisungen und Beschwerden des unteren Urogenitaltrakts (z. B. Hämaturie). Eine Reanalyse einer randomisierten kontrollierten Studie zeigte einerseits, dass Patientinnen und Patienten mit einem prognostisch eher ungünstigen Profil für eine EKT (jung, ohne psychotische Symptome) eher von einer intravenösen Ketaminbehandlung als von einer sehr kurzen EKT-Serie profitieren (26). Andererseits deutet eine vor Kurzem publizierte Metaanalyse auf eine eher geringe Effektstärke der Esketaminbehandlung als Add-on-Therapie zu Antidepressiva hin und konnte keine Wirksamkeit bezüglich einer Reduktion der Suizidalität nachweisen (27). Dies verdeutlicht die Notwendigkeit einer weiteren Stratifizierung von Subgruppen mit dem Ziel einer individualisierten Indikationsstellung für spezifische Hirnstimulationsverfahren.
Tiefe Hirnstimulation
In Fällen von schweren, andauernden depressiven Episoden, die sich weder auf Medikamente, spezifische Psychotherapie oder nicht invasiven Hirnstimulationsverfahren (rTMS, EKT) bessern, stellt die Tiefe Hirnstimulation (THS) eine invasive Behandlungsmethode dar. Mittels zweier, bilateral angebrachter Elektroden können tief im Gehirn gelegene Zielregionen stimuliert werden, wodurch dysfunktionale, die Krankheit aufrechterhaltende Netzwerke mittels elektrischer Stimuli beeinflusst werden. Bei neurologischen Erkrankungen wie Morbus Parkinson, Dystonien oder essenziellem Tremor findet die THS schon lange Zeit Anwendung. In der Psychiatrie wurde die THS zunächst bei therapieresistenten Zwangsstörungen, im weiteren Verlauf auch bei Depressionen eingesetzt. Zielregionen der THS-Depressionsbehandlung sind Kernregionen und Faserverbindungen des limbischen und des Belohnungssystems (28). Coenen und Kollegen entwickelten ein erweitertes Konzept des mittleren Vorderhirnbündels (29). Das mittlere Vorderhirnbündel verbindet Kernregionen des Belohnungssystems wie das ventrale Tegmentum mit dem Nucleus accumbens und dem orbitofrontalen Cortex. Mikrostrukturelle Veränderungen des mittleren Vorderhirnbündels stehen mit Anhedonie in Verbindung, einem Kernsymptom der Depression (30). Die basierend auf Bildgebungsmethoden gesteuerte DBS-Stimulation des mittleren Vorderhirnbündels könnte besonders wirksam sein, da so depressionsspezifische Netzwerke des Belohnungssystems moduliert werden, die zentral für die Pathophysiologie der Depression sind (31, 32). Bei der THS handelt es sich um eine in der Regel irreversible Operation. Neben mit der Operation assoziierten Risiken muss vor allem auch die Induktion einer Manie sorgfältig monitorisiert werden.
Psychedelika-assistierte Psychotherapie
Die Psychedelika-assistierte Psychotherapie (PAT) ist eine innovative Intervention, die aktuell als Behandlungsmöglichkeit für affektive und andere psychiatrische Störungen untersucht wird. Gegenwärtig kann die PAT in der Schweiz ausschliesslich im Rahmen von Studien oder einer Sonderbewilligung des Bundesamtes für Gesundheit (BAG) für die Behandlung mit Psychedelika (Psilocybin und LSD) durchgeführt werden. Bei der PAT wird strukturierte Psychotherapie mit einer Einnahme von klassischen Psychedelika wie Psilocybin oder Lysergsäurediethylamid (LSD) kombiniert. Die PAT ist meist unterteilt in Vorbereitungssitzungen, Substanzsitzungen und Integrationssitzungen, in denen die erlebten Erfahrungen psychotherapeutisch bearbeitet werden. Metaanalytisch zusammengefasst zeigen sich in bisherigen Studien Ansprechraten von etwa 60 % (33). Zugrunde liegende Wirkmechanismen der PAT sind noch nicht vollständig geklärt. Psychedelika induzieren Neuroplastizität, was im Tiermodell gut belegt ist (34). Dies könnte dazu beitragen, psychotherapeutische Prozesse zu augmentieren bzw. zu katalysieren. So sollen durch PAT zum einen pathologische Denk- und Verhaltensmuster sowie auch die Funktion von krankheitsrelevanten Hirnregionen verändert werden können (35). Vorteile der PAT sind die rasche, anhaltende Reduktion der depressiven Symptomatik bereits nach einmaliger Einnahme sowie das niedrige Risikoprofil in einer kontrollierten Umgebung mit Selektion von Patientinnen und Patienten ohne erhöhtes Psychose- oder Manierisiko (36). Unter Substanzwirkung können Ängste und Paranoia auftreten, die im klinischen Setting in schweren Fällen pharmakologisch behandelbar sind (37). Ob es als Folge der PAT zu Nachhallphänomenen kommen kann (hallucinogen persisting perception disorder), ist nicht abschliessend geklärt. Im Gegensatz dazu zeigte eine kürzlich publizierte Studie, dass unkontrollierter Konsum von Halluzinogenen in der Freizeit, der zu Vorstellungen auf einem Notfallzentrum führte, mit einem erhöhten Risiko einherging, eine Erkrankung aus dem psychotischen Formenkreis zu entwickeln (38). Die Schweizerische Gesellschaft für Psychiatrie und Psychotherapie publizierte 2024 erstmals Behandlungsrichtlinien. Wie auch bei der Ketaminbehandlung wird die Evaluation der Wirksamkeit durch Schwierigkeiten der Verblindung, selektionierte Patientinnen und Patienten und hohe Erwartungseffekte erschwert. Zudem fehlen gegenwärtig Langzeitstudien und gezielte Untersuchungen, inwiefern begleitende Psychotherapie wichtig ist.
Prädiktion, Kombination und individualisierte Behandlung
Oben genannte Behandlungsverfahren haben bei schwer behandelbaren Depressionen erhebliches Potenzial. Die technische Entwicklung und die Anzahl der laufenden Studien sind rasant. Abgesehen von der EKT-Behandlung, bei der es klare und verlässliche klinische Prädiktoren für therapeutisches Ansprechen gibt, steckt die individualisierte Medizin mit einer differenziellen Indikationsstellung für die jeweiligen Verfahren noch in den Anfängen. Physiologische Marker mit potenziell prädiktivem Wert (EKG, EEG, Laborparameter), die im Rahmen der Routineuntersuchungen erhoben werden, könnten relativ einfach in den klinischen Alltag implementiert werden (10). Neben der individualisierten Indikationsstellung für jeweilige Verfahren wird auch die Kombination verschiedener Verfahren (z. B. tDCS vor rTM) [22] oder als Erhaltungstherapie [23] EKT mit Ketaminnarkose [39]) untersucht. Zudem wird erforscht, ob Hirnstimulationsverfahren in Kombination mit Psychotherapie psychotherapeutische Effekte verstärken können.
Leiter Kompetenzzentrum für Interventionelle Psychiatrie und augmentierte Psychotherapie
Universitätsklinik für Psychiatrie und Psychotherapie
Murtenstrasse 21
3008 Bern
Schweiz
tobias.bracht@unibe.ch
Die Autorenschaft hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Kessler RC, Berglund P, Demler O, Jin R, Merikangas KR, Walters EE. Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiatry. 2005;62(6):593-602.
2. Rush AJ, Trivedi MH, Wisniewski SR, Nierenberg AA, Stewart JW, Warden D, et al. Acute and longer-term outcomes in depressed outpatients requiring one or several treatment steps: a STAR*D report. Am J Psychiatry. 2006;163(11):1905-17.
3. Sackeim HA. The definition and meaning of treatment-resistant depression. J Clin Psychiatry. 2001;62 Suppl 16:10-7.
4. Brunoni AR, Chaimani A, Moffa AH, Razza LB, Gattaz WF, Daskalakis ZJ, et al. Repetitive Transcranial Magnetic Stimulation for the Acute Treatment of Major Depressive Episodes: A Systematic Review With Network Meta-analysis. JAMA Psychiatry. 2017;74(2):143-52.
5. Grimm S, Beck J, Schuepbach D, Hell D, Boesiger P, Bermpohl F, et al. Imbalance between left and right dorsolateral prefrontal cortex in major depression is linked to negative emotional judgment: an fMRI study in severe major depressive disorder. Biol Psychiatry. 2008;63(4):369-76.
6. Cole EJ, Stimpson KH, Bentzley BS, Gulser M, Cherian K, Tischler C, et al. Stanford Accelerated Intelligent Neuromodulation Therapy for Treatment-Resistant Depression. Am J Psychiatry. 2020;177(8):716-26.
7. Rossi S, Antal A, Bestmann S, Bikson M, Brewer C, Brockmoller J, et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert Guidelines. Clin Neurophysiol. 2021;132(1):269-306.
8. Dalhuisen I, van Oostrom I, Spijker J, Wijnen B, van Exel E, van Mierlo H, et al. rTMS as a Next Step in Antidepressant Nonresponders: A Randomized Comparison With Current Antidepressant Treatment Approaches. Am J Psychiatry. 2024;181(9):806-14.
9. Papakostas GI, Trivedi MH, Shelton RC, Iosifescu DV, Thase ME, Jha MK, et al. Comparative effectiveness research trial for antidepressant incomplete and non-responders with treatment resistant depression (ASCERTAIN-TRD) a randomized clinical trial. Mol Psychiatry. 2024;29(8):2287-95.
10. Provaznikova B, Monn A, Seifritz E, Kronenberg G, Olbrich S. EEG alpha activity as predictor for TBS-rTMS treatment outcome in depression. J Psychiatr Res. 2025;182:4-12.
11. Group UER. Efficacy and safety of electroconvulsive therapy in depressive disorders: a systematic review and meta-analysis. Lancet. 2003;361(9360):799-808.
12. van Diermen L, Vanmarcke S, Walther S, Moens H, Veltman E, Fransen E, et al. Can psychomotor disturbance predict ect outcome in depression? J Psychiatr Res. 2019;117:122-8.
13. Breit S, Meyer A, Schmitt W, Bracht T, Walther S. The Effect of Electroconvulsive Therapy on Specific Catatonia Symptoms and Predictors of Late Response. Pharmacopsychiatry. 2024;57(1):13-20.
14. Bracht T, Walther S, Breit S, Mertse N, Federspiel A, Meyer A, et al. Distinct and shared patterns of brain plasticity during electroconvulsive therapy and treatment as usual in depression: an observational multimodal MRI-study. Transl Psychiatry. 2023;13(1):6.
15. Oltedal L, Narr KL, Abbott C, Anand A, Argyelan M, Bartsch H, et al. Volume of the Human Hippocampus and Clinical Response Following Electroconvulsive Therapy. Biol Psychiatry. 2018;84(8):574-81.
16. Ulrich S, Schneider E, Deuring G, Erni S, Ridder M, Sarlon J, et al. Alterations in resting-state EEG functional connectivity in patients with major depressive disorder receiving electroconvulsive therapy: A systematic review. Neurosci Biobehav Rev. 2025;169:106017.
17. Woodham RD, Selvaraj S, Lajmi N, Hobday H, Sheehan G, Ghazi-Noori AR, et al. Home-based transcranial direct current stimulation treatment for major depressive disorder: a fully remote phase 2 randomized sham-controlled trial. Nat Med. 2025;31(1):87-95.
18. Brunoni AR, Moffa AH, Sampaio-Junior B, Borrione L, Moreno ML, Fernandes RA, et al. Trial of Electrical Direct-Current Therapy versus Escitalopram for Depression. N Engl J Med. 2017;376(26):2523-33.
19. Fregni F, El-Hagrassy MM, Pacheco-Barrios K, Carvalho S, Leite J, Simis M, et al. Evidence-Based Guidelines and Secondary Meta-Analysis for the Use of Transcranial Direct Current Stimulation in Neurological and Psychiatric Disorders. Int J Neuropsychopharmacol. 2021;24(4):256-313.
20. Aust S, Brakemeier EL, Spies J, Herrera-Melendez AL, Kaiser T, Fallgatter A, et al. Efficacy of Augmentation of Cognitive Behavioral Therapy With Transcranial Direct Current Stimulation for Depression: A Randomized Clinical Trial. JAMA Psychiatry. 2022;79(6):528-37.
21. Burkhardt G, Kumpf U, Crispin A, Goerigk S, Andre E, Plewnia C, et al. Transcranial direct current stimulation as an additional treatment to selective serotonin reuptake inhibitors in adults with major depressive disorder in Germany (DepressionDC): a triple-blind, randomised, sham-controlled, multicentre trial. Lancet. 2023;402(10401):545-54.
22. Zhou D, Li X, Wei S, Yu C, Wang D, Li Y, et al. Transcranial Direct Current Stimulation Combined With Repetitive Transcranial Magnetic Stimulation for Depression: A Randomized Clinical Trial. JAMA Netw Open. 2024;7(11):e2444306.
23. Razza LB, De Smet S, Moffa A, Sudbrack-Oliveira P, Vanderhasselt MA, Brunoni AR. Follow-up effects of transcranial direct current stimulation (tDCS) for the major depressive episode: A systematic review and meta-analysis. Psychiatry Res. 2021;302:114024.
24. McIntyre RS, Rosenblat JD, Nemeroff CB, Sanacora G, Murrough JW, Berk M, et al. Synthesizing the Evidence for Ketamine and Esketamine in Treatment-Resistant Depression: An International Expert Opinion on the Available Evidence and Implementation. Am J Psychiatry. 2021;178(5):383-99.
25. Calder CN, Kwan ATH, Teopiz KM, Wong S, Rosenblat JD, Mansur RB, et al. Number needed to treat (NNT) for ketamine and esketamine in adults with treatment-resistant depression: A systematic review and meta-analysis. J Affect Disord. 2024;356:753-62.
26. Jha MK, Wilkinson ST, Krishnan K, Collins KA, Sanacora G, Murrough J, et al. Ketamine vs Electroconvulsive Therapy for Treatment-Resistant Depression: A Secondary Analysis of a Randomized Clinical Trial. JAMA Netw Open. 2024;7(6):e2417786.
27. Fountoulakis KN, Saitis A, Schatzberg AF. Esketamine Treatment for Depression in Adults: A PRISMA Systematic Review and Meta-Analysis. Am J Psychiatry. 2025:appiajp20240515.
28. Dandekar MP, Fenoy AJ, Carvalho AF, Soares JC, Quevedo J. Deep brain stimulation for treatment-resistant depression: an integrative review of preclinical and clinical findings and translational implications. Mol Psychiatry. 2018;23(5):1094-112.
29. Coenen VA, Panksepp J, Hurwitz TA, Urbach H, Madler B. Human medial forebrain bundle (MFB) and anterior thalamic radiation (ATR): imaging of two major subcortical pathways and the dynamic balance of opposite affects in understanding depression. J Neuropsychiatry Clin Neurosci. 2012;24(2):223-36.
30. Bracht T, Mertse N, Walther S, Ludi K, Breit S, Federspiel A, et al. Link between structural connectivity of the medial forebrain bundle, functional connectivity of the ventral tegmental area, and anhedonia in unipolar depression. Neuroimage Clin. 2022;34:102961.
31. Coenen VA, Bewernick BH, Kayser S, Kilian H, Bostrom J, Greschus S, et al. Superolateral medial forebrain bundle deep brain stimulation in major depression: a gateway trial. Neuropsychopharmacology. 2019;44(7):1224-32.
32. Persad AR, Coote NR, Waterhouse K, McLeod S, Norton JA, Gould L, et al. Medial forebrain bundle stimulation after failed subcallosal cingulate deep brain stimulation for treatment-resistant depression: Efficacy of a dual deep brain stimulation system for depression. Brain Stimul. 2024;17(1):68-70.
33. Haikazian S, Chen-Li DCJ, Johnson DE, Fancy F, Levinta A, Husain MI, et al. Psilocybin-assisted therapy for depression: A systematic review and meta-analysis. Psychiatry Res. 2023;329:115531.
34. Calder AE, Hasler G. Towards an understanding of psychedelic-induced neuroplasticity. Neuropsychopharmacology. 2023;48(1):104-12.
35. van Elk M, Yaden DB. Pharmacological, neural, and psychological mechanisms underlying psychedelics: A critical review. Neurosci Biobehav Rev. 2022;140:104793.
36. Muttoni S, Ardissino M, John C. Classical psychedelics for the treatment of depression and anxiety: A systematic review. J Affect Disord. 2019;258:11-24.
37. Hinkle JT, Graziosi M, Nayak SM, Yaden DB. Adverse Events in Studies of Classic Psychedelics: A Systematic Review and Meta-Analysis. JAMA Psychiatry. 2024;81(12):1225-35.
38. Myran DT, Pugliese M, Xiao J, Kaster TS, Husain MI, Anderson KK, et al. Emergency Department Visits Involving Hallucinogen Use and Risk of Schizophrenia Spectrum Disorder. JAMA Psychiatry. 2025;82(2):142-50.
39. Sicignano DJ, Kantesaria R, Mastropietro M, Sedensky A, Kohlbrecher R, Hernandez AV, et al. The Impact of Ketamine-Based Versus Non-Ketamine-Based ECT Anesthesia Regimens on the Severity of Patients‘ Depression and Occurrence of Adverse Events: A Systematic Review with Meta-Analysis. Ann Pharmacother. 2025;59(3):250-61.
Therapeutische Umschau
- Vol. 82
- Ausgabe 2
- April 2025