- Kardiale Dyspnoe
Dyspnoe wird häufig durch eine kardiale Grunderkrankung ausgelöst. Unbehandelt besteht eine schlechte Prognose. Daher sollte bei jedem Verdacht auf eine kardiale Genese oder unklarer Dyspnoe eine kardiologische Abklärung erfolgen und eine spezifische Therapie eingeleitet werden. Dieser Artikel gibt eine praxisorientierte Übersicht über die wichtigsten Abklärungsschritte, Ursachen und Therapieprinzipien.
Einleitung
Das Leitsymptom Dyspnoe ist eine häufige Fragestellung für niedergelassene wie auch Spitalärzte, und die Ursachen unterscheiden sich im ambulanten oder Spitalsetting zum Teil deutlich (1): stehen in der Hausarztpraxis eher infektiöse oder respiratorische Ursachen im Vordergrund, sind in der Notfallmedizin häufiger kardiale Gründe anzutreffen.
Dieser Artikel soll einen praxisrelevanten Überblick über die wichtigsten kardialen Ursachen, die nötigen Abklärungsschritte und die jeweilige Therapie verschaffen.
Anamnese und Status
Hauptsymptom ist eine häufig progrediente Anstrengungsdyspnoe und schnellere Ermüdbarkeit (s. Tabelle 1). In Ruhe können eindeutige pathologische Befunde fehlen. Manche Patienten meiden unbewusst körperliche Belastungen, so dass die Fremdanamnese wichtig ist und allenfalls ein Belastungstest weiterhelfen kann.
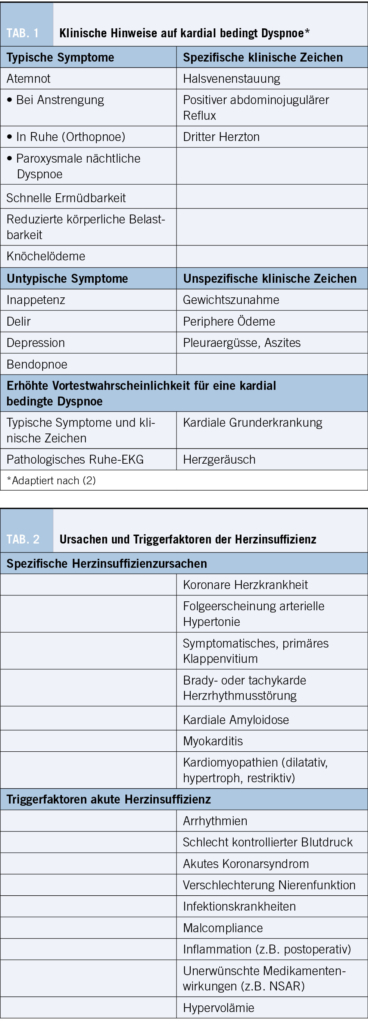
Besonderes Augenmerk sollte auf klinische Zeichen der Herzinsuffizienz und die Herz- und Lungenauskultation gelegt werden. Die Vortest-Wahrscheinlichkeit ist erhöht, wenn eine kardiale Grunderkrankung, kardiovaskuläre Risikofaktoren oder ein pathologisches Ruhe-EKG vorliegen. Ebenfalls sollten spezifische Trigger wie eine Arrhythmie, bestimmte körperliche Belastungen und andere Begleitumstände erfragt werden. In den jeweiligen Unterkapiteln wird vertieft auf spezielle Symptome eingegangen.
Diagnostische Abklärungen
Basisabklärung Hausarztpraxis: Anamnese und klinische
Untersuchung, 12-Kanal-EKG mit Rhythmusstreifen, Röntgen Thorax, breites internistisches Basislabor, inkl. NT-pro BNP
Weiterabklärung Kardiologie: Anamnese und klinische Untersuchung, Echokardiographie, ggf. rhythmologische Dia-
gnostik, ggf. Ergometrie/ Spiroergometrie, ggf. nicht-invasive Tests mit Frage nach Ischämie oder morphologischen Fragestellungen (Stress-Echokardiographie, Herz-MRI, Koronar-CT, Myokardszintigraphie), ggf. Rechts-Links-Herzkatheter.
Herzinsuffizienz als Dyspnoe-Ursache
Hintergründe
Zahlreiche medizinische Fortschritte haben zu einer deutlich höheren Lebenserwartung geführt, parallel kommt es jedoch durch die Alterung und Spätfolgen kardiovaskulärer Erkrankungen zu einem zunehmenden Auftreten der (chronischen) Herzinsuffizienz (HI).Akut kann eine HI bei einer hypertensiven Entgleisung, Arrhythmien oder einem Myokardinfarkt und anderen Triggerfaktoren (s. Tabelle 2) auftreten – insbesondere wenn das Herz bereits vorbelastet ist. Die Mortalität ist hoch und steigt mit jeder Hospitalisation. Innerhalb von 5 Jahren sterben 50%
der Betroffenen.
Anamnese und Status
Das Kardinalsymptom Dyspnoe äussert sich in leichteren Fällen nur bei körperlicher Anstrengung, in einem fortgeschrittenen Stadium kommt es zu einer zunehmenden Leistungsintoleranz und schnelleren Ermüdbarkeit, Nykturie sowie paroxysmal auftretender nächtlicher Dyspnoe im Liegen bis hin zu einer Ruhedyspnoe. Häufig bestehen Halsvenenstauung, Beinödeme und Inappetenz (s. Tabelle 1).
Diagnostik
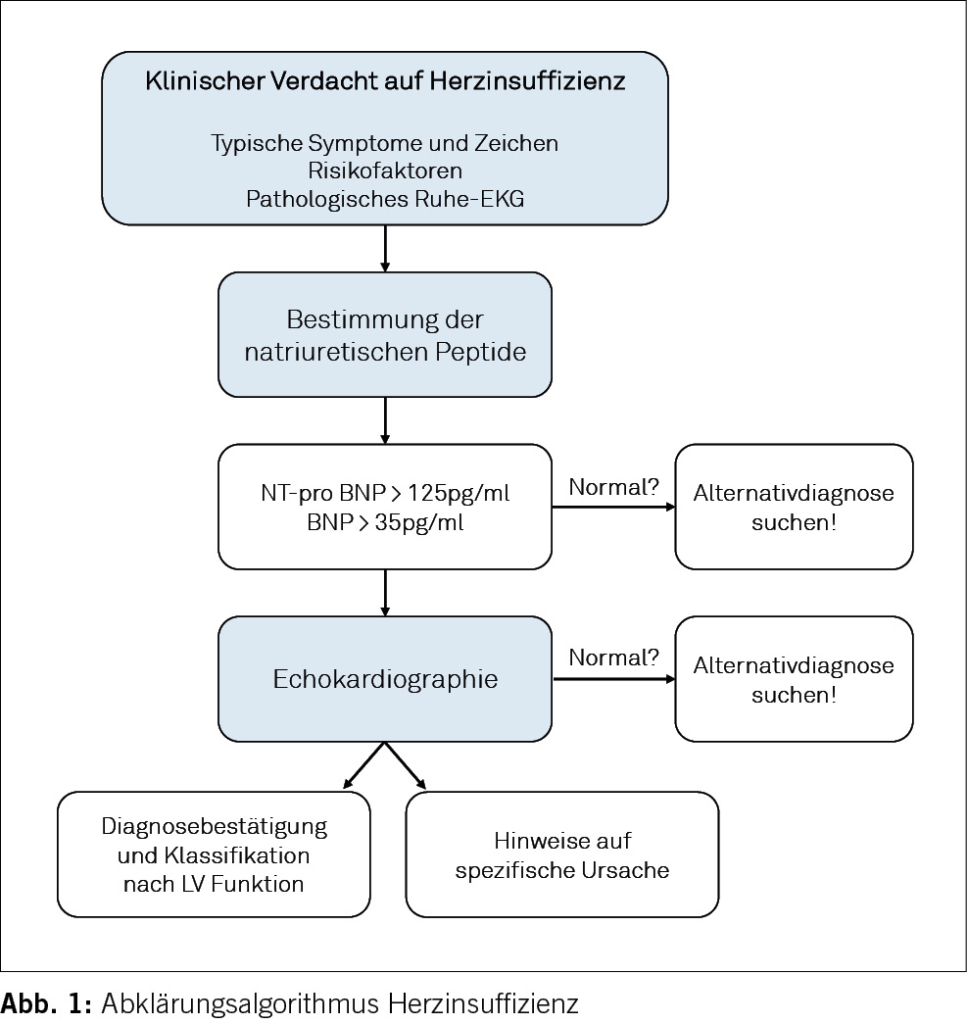
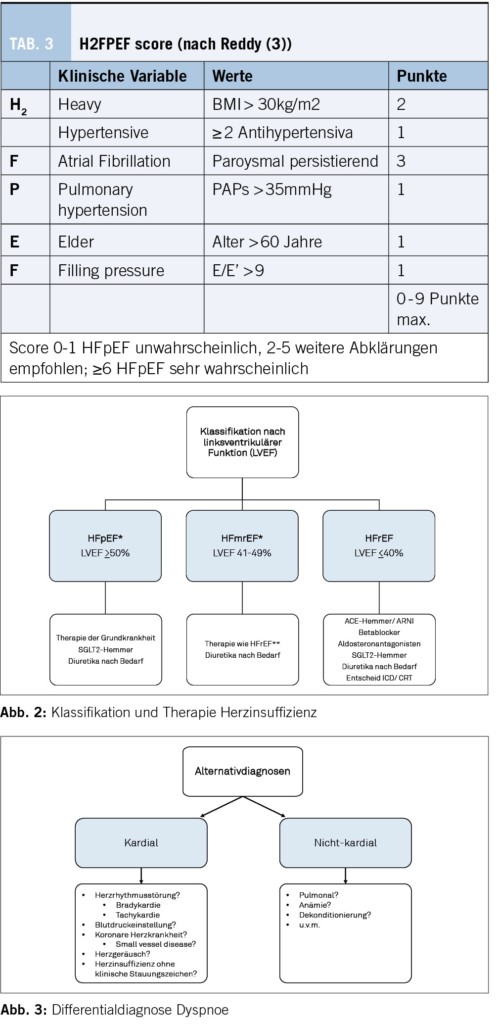
Der Algorithmus der European Society of Cardiology (2, Abbildung 1) sieht bei typischen klinischen Zeichen und Symptomen der HI eine Bestimmung der natriuretischen Peptide vor. Bei tiefen Werten ist eine HI mit hoher Sicherheit ausgeschlossen (NT-pro BNP <125pg/ml oder BNP <35pg/ml). Im anderen Fall sollte mit einer Echokardiographie eine strukturelle Herzkrankheit gesucht werden. Der echokardiographische Phänotyp stellt die Weichen zur weiteren differentialdiagnostischen Abklärung. Die Bestimmung der linksventrikulären Ejektionsfraktion (LVEF) ist wesentlich zur Festlegung der weiteren Therapie (Abbildung 2). Die Diagnose einer HI mit erhaltener Pumpfunktion kann bei fehlenden Stauungszeichen mithilfe von validierten Scores wie dem H2FPEF-Score (3) (s. Tabelle 3) erleichtert werden.
Therapie
Bei einer Herzinsuffizienz mit reduzierter linksventrikulärer Pumpfunktion (LVEF <40%, HFrEF) besteht die Basistherapie aus vier Medikamenten, die in den jeweiligen Studien zu einer Mortalitätssenkung und Reduktion der Hospitalisationsrate geführt haben: ACE-Hemmer oder Angiotensin-Rezeptor-Neprilysin-Inhibitoren (ARNI), kardioselektive Betablocker, Mineralokortikoid-Rezeptorantagonisten und Sodium-Glukose-Cotransporter 2 (SGLT2) -Inhibitoren. Im Gegensatz zu früheren Empfehlungen soll heutzutage diese Kombinationstherapie nach spätestens vier Wochen etabliert sein und gemäss Verträglichkeit auf die empfohlenen Zieldosierungen auftitriert werden. Bezüglich der Reihenfolge der Medikamente empfiehlt sich eine individualisierte Herangehensweise, um Nebenwirkungen wie eine symptomatische Hypotonie, zunehmende Niereninsuffizienz oder Elektrolytstörungen zu vermeiden (2). Die Dosierung der Diuretika richtet sich nach dem klinischen Bedarf.
Reversible Ursachen wie ein primäres schwergradiges Klappenvitium sollten interventionell oder chirurgisch beseitigt werden (s. Abschnitt Klappenvitien). Ist eine koronare Herzkrankheit Ursache der HI, hat die chirurgische Myokardrevaskularisation mit optimaler medikamentöser Therapie die aktuell beste Evidenz bezüglich Überleben und Rehospitalisationsrate (4), für eine perkutane Revaskularisation ist dies nicht belegt (5). Für die kardiale (ATTR-) Amyloidose steht mit Tafamidis eine spezifische, jedoch sehr teure Therapie zur Verfügung (6). Bei persistierender Funktionseinschränkung des linken Ventrikels muss zur Vorbeugung des plötzlichen Herztodes durch maligne ventrikuläre Arrhythmien ein implantierbarer Cardioverter-Defibrillator und bei breitem Linksschenkelblock eine kardiale Resynchronisationstherapie mit oder ohne Defibrillator diskutiert werden (2).
Bei einer Herzinsuffizienz mit erhaltener Pumpfunktion (LVEF > 50% und strukturelle Herzveränderungen, HFpEF) gibt es neu sehr gute Evidenz für die Klasse der SGLT2-Inhibitoren Dapagliflozin und Empagliflozin bezüglich der Senkung von Mortalität und Hospitalisation (7,8). ACE-Hemmer, Sartane, ARNI und Betablocker sind bei HFpEF ungenügend wirksam (2).
Bei einer Herzinsuffizienz mit einer linksventrikulärePumpfunktion im mittleren Bereich zwischen 40 und 50% (HFmrEF) ist die Studienlage zur Zeit noch spärlich (2). Es gibt jedoch viele Hinweise aus Subanalysen, dass die HFrEF-Therapie wirksam ist. Die aktuelle DELIVER-Studie schloss HFmrEF-Patienten bis zu einer LVEF von 40% ein und zeigte dort den gleichen, konsistenten Benefit von Dapagliflozin wie in anderen Patientengruppen (7). Somit können SGLT2-Hemmer bei allen HI-Patienten bei fehlenden Kontraindikationen eingesetzt werden.
Prognose
NYHA-Stadium, Ausmass der Kontraktionseinschränkung der Ventrikel, begleitende Klappenvitien, Komorbiditäten wie Niereninsuffizienz, ein ungenügender Therapieausbau, Hospitalisationen u.v.m. haben direkten Einfluss auf die Prognose der Patientinnen und Patienten.
Arterielle Hypertonie
Hintergrund
Die arterielle Hypertonie (AH) ist eine heutzutage gut behandelte Volkskrankheit geworden. Dennoch kommt es häufig zu morphologischen Veränderungen des Herzens – einerseits als Frühschaden, wenn der Bluthochdruck zu spät erkannt und therapiert wird und andererseits als Spätfolge insbesondere bei nicht optimal erreichten Zielwerten.
Akut kann eine hypertensive Krise ein Lungenödem durch eine stark erhöhte Nachlast durch arterielle Vasokonstriktion und/oder durch eine Volumenverschiebung aus dem Splanchnikusgebiet auftreten (9). Ebenfalls kann ein ungenügend eingestellter Blutdruck unter körperlicher Belastung exazerbieren und zu Dyspnoe und thorakalem Druckgefühl führen.
Kardiale Spätfolgen der AH sind häufig eine linksventrikuläre Hypertrophie, diastolische Dysfunktion mit der möglichen Konsequenz einer Herzinsuffizienz sowie eine koronare Herzerkrankung und Vorhofflimmern.
Anamnese
Oft haben Patienten keine spezifischen Symptome und die AH wird zufällig entdeckt. Hypertonie-assoziierte Beschwerden sind Kopfschmerzen, Thoraxschmerzen und Dyspnoe. Bei neuentdeckter AH und begleitender Dyspnoe sollte bei fehlender Verbesserung unter optimaler Therapie eine kardiologische Evaluation zur Suche weiterer Dyspnoegründe erfolgen. Bei langjährig bekannter AH sollte die medikamentöse Compliance und die ambulante Blutdruckeinstellung evaluiert werden.
Diagnostik
Blutdruckmessungen in der Arztpraxis oder ambulante Selbstmessungen. Ggf. ambulante 24-Stunden-Blutdruckmessung. 12-Kanal-Ruhe-EKG: linksventrikulären Hypertrophie, Vorhofflimmern, Hinweise auf KHK?
Hypertensive Folgeschäden evaluieren: Nieren, Augen, Neurologie Kardiologische Abklärung als Standortbestimmung oder bei fehlender Verbesserung trotz adäquater Therapie.
Therapie
Die Blutdrucktherapie sollte sich an den aktuellen ESC-Richtlinien (10) und an den Komorbiditäten orientieren.
Koronare Herzkrankheit
Hintergrund
Bei koronarer Herzkrankheit (KHK) entwickeln bis 40% der Patienten eine Herzinsuffizienz. Einerseits akut/subakut im Rahmen eines Myokardinfarktes (kardiogener Schock, Papillarmuskelabriss Mitralklappe) oder chronisch durch eine ischämische Kardiomyopathie oder eine ischämische Mitralklappeninsuffizienz.
Neben fokaler epikardialer Stenosen kann die Myokardperfusion speziell bei Diabetikern oder ausgeprägter Atherosklerose diffus oder auf kapillärer Ebene («small vessel disease») beeinträchtigt sein und zu Dyspnoe und Angina pectoris führen (11).
Anamnese
Kardinalsymptom ist die Angina pectoris, seltener kommt es zu einer Dyspnoe als Angina-pectoris-Äquivalent, bei der häufiger proximale Koronarstenosen zu finden sind (12).
Akut kann Dyspnoe bei einem grossen Myokardinfarkt oder einer Herzinsuffizienz auftreten.
Diagnostik
Bei Dyspnoe unklarer Ätiologie und erhöhtem kardiovaskulären Risikoprofil sollte nach einer kardiologischen Basisabklärung eine myokardiale Ischämie, resp. Koronarstenosen am besten mit einem nicht-invasiven Test wie Stress-Echokardiographie, Herz-MRI, Myokardszintigraphie oder einem Koronar-CT gesucht werden.
Bei bekannter KHK empfiehlt sich eine Echokardiographie zum Ausschluss neuer Wandbewegungsstörungen oder Klappeninsuffizienz sowie zur Bestimmung der linksventrikulären Funktion. Niederschwellig erfolgt ein nicht-invasiver Ischämietest bei fehlender anderer Erklärung der Dyspnoe.
Bei Dyspnoe in Kombination mit Angina pectoris sollte ohne weiteren Test eine Koronarangiographie erfolgen, sonst nur bei Ischämienachweis in der nicht-invasiven Bildgebung. Bei einem Myokardinfarkt mit kardiogenem Schock ist eine Notfall-Koronarangiographie indiziert.
Therapie
Bei symptomatischen Koronarstenosen sollte neben der medikamentösen Therapie eine perkutane transluminale Koronarangioplastie mit Stenteinlage (PTCA) und in ausgewählten Fällen die aortokoronare Bypass-Chirurgie (ACBP) evaluiert werden.
Bei diffuser Koronarsklerose ohne Bypass-fähige Anschlussgefässe oder einer small-vessel-disease steht die pharmakologische Therapie mit Antianginosa im Vordergrund (Betablocker, Kalziumantagonisten)(11).
Falls eine KHK Ursache einer Herzinsuffizienz mit eingeschränkter Pumpfunktion ist, stellt die ACBP zusammen mit einer optimal ausgebauten Herzinsuffizienztherapie die beste Therapieoption bei geeigneten Patienten dar, da trotz anfangs höherer Mortalität in der Operationsgruppe über 10 Jahre ein deutlicher Überlebensvorteil besteht (4).
Klappenvitien
Hintergrund
Die Herzklappen gewährleisten durch ihre Ventilfunktion einen nach vorwärts gerichteten Blutfluss und fördern dabei im Herzzyklus die optimale Füllung und Entleerung der jeweiligen Herzkammern.
Die Aorten- und Pulmonalklappe sind sog. Taschenklappen, die sich abhängig von den Druck- und Flussverhältnissen passiv öffnen und schliessen. Die Aortenklappe ist dem höchsten mechanischen Stress ausgesetzt und hat häufig degenerative Veränderungen bis hin zur Stenose. Bei bikuspiden Aortenklappen geschieht dies deutlich schneller. Durch Degeneration und/oder Dilatation des Aortenannulus kann es zur Insuffizienz kommen.
Die Mitral- und Trikuspidalklappe sind als Segelklappen anatomisch und funktionell komplexer aufgebaut. Die funktionelle Einheit besteht aus Klappensegeln, Annulus und dem subvalvulären Apparat mit Sehnenfäden und Papillarmuskeln. Die Funktionsstörung einer Ebene kann das gesamte Klappengefüge stören und zur Dysfunktion führen.
Prinzipiell wird zwischen primären und sekundären Klappenvitien unterschieden:
Bei primären Vitien führt eine primäre Störung des Herzklappenapparates zur Fehlfunktion der Klappe. Ein klassischer Fall wäre eine akute Herzinsuffizienz wegen eines akuten Sehnenfadenabrisses bei vorbestehendem Mitralklappenprolaps oder eine langsam fortschreitende Aortenklappenstenose.
Sekundäre Vitien entstehen auf dem Boden einer Störung des Herzens selbst (z.B. durch eine Erweiterung des Mitralklappenannulus mit geringerer Koaptationsfläche beider Mitralsegel bei dilatativer Kardiomyopathie).
Anamnese
Typischerweise verursachen Klappenvitien anstrengungsabhängige Symptome, können aber in einem fortgeschrittenen Stadium auch in Ruhe symptomatisch sein und sich als akute Herzinsuffizienz präsentieren. In der Regel kommt es zu einer langsam progredienten Leistungsintoleranz und Dyspnoe. Akute Verschlechterungen treten oft sekundär wie z.B. bei einer Tachyarrhythmie oder Infektion auf.
Klassische Symptome der schweren Aortenklappenstenose sind Schwindel oder Synkope bei körperlicher Anstrengung, Angina pectoris und Herzinsuffizienz. Rechtsherzinsuffizienzzeichen wie Beinödeme, gestaute Halsvenen, Inappetenz durch gastrische und hepatische Stauung sowie Aszites können bei schwerer Trikuspidalklappeninsuffizienz auftreten. Pulmonalklappenvitien sind bei Erwachsenen eher selten relevant.
Diagnostik
Der wegweisende Befund bleibt die klassische Herzauskultation, bei der ein Grossteil relevanter Klappenvitien festgestellt werden kann. Eine schwere Aortenklappenstenose oder Mitralklappeninsuffizienz werden dadurch selten überhört werden. Hingegen können diastolische Geräusche auskultatorisch wenig eindrücklich sein.
Die Lautstärke des Systolikums sagt nichts über den Schweregrad des Klappenvitiums aus.
Niedrigfrequente Herzgeräusche stellen bei fehlenden Symptomen oder klinischen Zeichen einer Herzinsuffizienz meist keine relevante Pathologie dar, wohingegen jedes hochfrequente Systolikum, jedes Diastolikum und jedes Herzgeräusch mit Herzinsuffizienzsymptomen oder Fieber weiter kardiologisch abgeklärt werden sollte.
Mit der (transthorakalen) Echokardiographie können sämtliche Herzvitien zuverlässig erkannt, die Ätiologie geklärt und die Schwere des Vitiums graduiert werden. Wichtige prognostische Zusatzinformationen wie Funktion, Morphologie und Grösse beider Ventrikel, eine pulmonale Hypertonie sowie Hinweise auf eine Stauung (Vena cava inferior, Pleuraergüsse) werden unkompliziert erfasst. Bei spezifischen Fragestellungen oder ungenügender Bildqualität kann die transoesophageale Echokardiographie Licht ins Dunkel bringen.
Therapie
Die Behandlung richtet sich prinzipiell nach den klinischen Beschwerden, Schweregrad und Pathoanatomie des Vitiums und der linksventrikulären Funktion (13).
In der Regel führen erst schwergradige Klappenvitien zu entsprechenden Symptomen.
Sekundäre Faktoren wie eine tachykarde Herzrhythmusstörung (v.a. Vorhofflimmern), eine Anämie oder eine Infektion können auch mittelschwere Vitien symptomatisch werden lassen. Hier sollte zuerst der sekundäre Faktor verbessert und die medikamentöse Therapie optimiert werden, bevor ein Klappeneingriff diskutiert werden sollte.
Bei polymorbiden und betagten Patienten finden sich häufig mehrere Gründe für eine Dyspnoe, so dass es im Einzelfall schwierig werden kann, eine einzige kausale Ursache zu identifizieren. Hier empfiehlt sich eine pragmatische Herangehensweise.
Primäre, symptomatische Klappenvitien müssen in der Regel durch eine Korrektur der Klappenpathologie therapiert werden – d.h. einer Klappenrekonstruktion oder einem -ersatz. Heutzutage steht eine Vielzahl an klassischen herzchirurgischen wie auch interventionellen Verfahren zur Verfügung, deren Einsatz abhängig von Anatomie, Begleiterkrankungen und Lebensalter ist. Über die für die Patienten am besten geeignete Modalität findet in der Regel eine lebhafte Diskussion im gemeinsamem Rapport der Kardiologie und Herzchirurgie statt.
Sekundäre, symptomatische Vitien verbessern sich oft durch eine Behandlung der Grunderkrankung – so kann beispielsweise bei einer Herzinsuffizienz mit sekundärer Mitralklappeninsuffizienz der Schweregrad und die entsprechende Symptomatik deutlich durch einen Ausbau der medikamentösen Herzinsuffizienztherapie – insbesondere durch eine adäquate Diuretikadosierung und Senkung der Nachlast – verbessert werden. Falls dies nicht zum gewünschten Erfolg führt und die Herzerkrankung noch nicht zu weit fortgeschritten ist, bestehen auch hier chirurgische und interventionelle Therapieverfahren zur Verfügung.
Die aktuellen Richtlinien der European Society of Cardiology geben einen guten Überblick über Behandlungsindikationen und Entscheidungsalgorithmen (13).
Prognose
Unbehandelte schwere Klappenvitien mit Symptomen oder einer linksventrikulären Dysfunktion haben eine schlechte Prognose und sollten frühzeitig behandelt werden. Komplexer wird die Situation bei einem schwergradigem Klappenvitium ohne subjektive Beschwerden: abhängig vom Klappenvitium existieren Evidenz-abgestützte Empfehlungen, ab welchen morphologischen oder klinischen Parametern eine Klappenkorrektur erforderlich ist.
Rhythmogene Dyspnoe-Ursachen
Hintergründe
Eine elektrisch koordinierte Kontraktion des Herzmuskels ermöglicht einerseits die optimale Füllung in der Diastole und andererseits die Entleerung der Ventrikel in der Systole. Zusätzlich wird die Herzaktion durch das vegetative Nervensystem und humorale Faktoren reguliert. Tachy- wie auch bradykarde Rhythmusstörungen können diese Abläufe negativ beeinflussen.
Anamnese
Neben dem Auftreten von Herzinsuffizienzsymptomen können Beschwerden wie schnellere Ermüdbarkeit und Leistungsintoleranz sowie Schwindel, Palpitationen oder Synkopen auftreten.
Diagnostik
12-Kanal-Ruhe-EKG als Basis.
Niedrigschwellig Langzeit-EKG (ein-bis-sieben-Tage-EKG, implantierbare Looprekorder mit Untersuchungszeitraum bis 4,5 Jahre; Abfrage Ereignisspeicher Herzschrittmacher oder Defibrillatoren; künstliche Intelligenz in «wearables»). Belastungs-EKG bei Verdacht auf belastungsinduzierte Arrhythmien.
Tachykarde Rhythmusstörungen
Vorhofflimmern
Vorhofflimmern ist die häufigste Arrhythmie im höheren Lebensalter und führt bei dekompensierter Herzinsuffizienz oft zur Hospitalisation.
Jüngere, aktive Menschen spüren meist unmittelbar eine Leistungseinbusse, hingegen haben ältere PatientInnen häufig nur Symptome bei einer ausgeprägter Tachykardie. Knapp 50% der Betroffenen bemerken keinen unregelmässigen Puls. Daher ist die Anamnese alleine zur Diagnosestellung unzuverlässig, sondern sollte immer mit einem 12-Kanal- oder Langzeit-EKG verifiziert werden.
Bei neudiagnostiziertem Vorhofflimmern empfiehlt sich eine kardiologische Abklärung, um eine strukturelle Herzerkrankung zu suchen und eine spezifische Behandlung einleiten zu können. Die Therapie richtet sich prinzipiell nach den Symptomen und der Herzfunktion. Junge und relativ gesunde Patienten profitieren von einer Rhythmuskontrolle, wobei initial eine Elektrokonversion durchgeführt werden kann und niederschwellig eine interventionelle Ablationsstrategie mit Pulmonalvenenisolation (PVI) evaluiert werden sollte (14).
Langdauerndes unbehandeltes tachykardes Vorhofflimmern kann zu einer dilatativen Kardiomyopathie führen («Tachykardiomyopathie»), die bei optimaler pharmakologischer Therapie mit Rhythmuskontrolle reversibel sein kann.
Bei ausgewählten Patienten mit einer Herzinsuffizienz mit eingeschränkter Pumpfunktion kann nach vorheriger medikamentöser Therapieoptimierung eine PVI die Mortalitäts- und Rehospitalisationsrate bis zu 38% senken (15). Ältere Patienten benötigen häufig nur eine gute Herzfrequenzkontrolle, die primär mit einem Betablocker o.ä. erzielt werden kann. Sollte bei Akut-Patienten eine instabile Hämodynamik vorliegen, sind Betablocker kontraindiziert, und es sollte eine Elektrokonversion oder Therapie mit Amiodarone evaluiert werden.
Besteht ein bradykardes Vorhofflimmern oder ein Tachykardie-Bradykardie-Syndrom, kann eine Herzschrittmacherimplantation als Bradykardieschutz und zur Wiederherstellung der Chronotropie nötig werden.
Da ebenfalls das Risiko von cerebralen oder peripheren Embolien erhöht ist, muss bei jedem Patienten ein Screening der Risikofaktoren gemäss CHA2DS2Vasc-Score erfolgen und eine therapeutische Antikoagulation evaluiert werden.
Herzschrittmacher und Dyspnoe
Herzschrittmacher werden bei bradykarden Herzrhythmusstörungen und biventrikuläre Systeme zur kardialen Resynchronisation bei Herzinsuffizienz mit eingeschränkter Pumpfunktion eingesetzt (16).
Bei Auftreten von Dyspnoe sind schrittmacherassoziierte von herzkrankheitbedingten Ursachen abzugrenzen. Fehlfunktionen des Schrittmachersystems müssen ausgeschlossen werden, auch wenn dies selten der Fall ist. Der Speicher des Herzschrittmachers kann Auskunft über neue Arrhythmien wie Vorhofflimmern, dem Ausmass ventrikulärer Extrasystolie oder Kammertachykardien, aber auch den prozentualen Anteil der Schrittmacherstimulation geben. Es empfiehlt sich, die programmierten Parameter zu überprüfen und zu adaptieren. Beispielsweise kann der Schrittmacher bei einer suboptimalen Sensoreinstellung das Herzfrequenzverhalten nicht gemäss Aktivitätsniveau des Patienten steuern. Sind die AV- und andere Intervalle unzureichend programmiert, kann der Schrittmacher in höheren Herzfrequenzbereichen einen 2:1-Block mit entsprechender Halbierung der Herzfrequenz induzieren und entsprechende Symptome auslösen.
Wenn hier keine Ursache zu finden ist, sollte eine Echokardiographie neue Klappenvitien, regionale Wandbewegungsstörungen (als Ausdruck eines zwischenzeitlichen Myokardinfarkts) und eine Verschlechterung der Pumpfunktion ausschliessen. Herkömmliche Schrittmachersysteme induzieren eine unphysiologische rechtsventrikuläre Erregung und können dadurch bei häufiger ventrikulärer Stimulation eine Schrittmacher-induzierte Kardiomyopathie auslösen. Nach einer Optimierung der Schrittmachereinstellungen zur Reduktion der ventrikulären Stimulationsrate und einem Ausbau der Herzinsuffizienztherapie kann bei fehlender Verbesserung in einigen Fällen eine Erweiterung auf ein biventrikuläres Schrittmachersystem nötig werden. Neue Therapieansätze wie eine gezielte Stimulation des Reizleitungssystems (17) könnten diese Problematik verbessern, klärende Studien dazu sind jedoch noch ausstehend.
Bradykarde Rhythmusstörungen und chronotrope Inkompetenz
Kann bei einer körperlichen Belastung die Herzfrequenz und damit das Herzzeitvolumen nicht adäquat gesteigert werden, spricht man von einer chronotropen Inkompetenz.
Ursächlich besteht oft eine Sinusknoten-Dysfunktion («Sick-sinus-Syndrom»), die durch altersabhängige Fibrose und Degeneration des Sinusknotens und der Vorhöfe entsteht.
Nicht selten bestehen begleitend auch tachykarde Rhythmusstörungen wie Vorhofflimmern oder atriale Tachykardien, die eine medikamentöse Frequenzkontrolle nötig machen und daher einen häufigen Grund für eine Herzschrittmacherimplantation als Bradykardieschutz darstellen .
Abzugrenzen davon sind extrinsisch verursachte Bradykardien bei beispielsweise Elektrolytstörungen, Hypothyreose, erhöhtem Vagotonus oder iatrogen unter bradykardisierender Therapie. Hier sollte zuerst die Grundproblematik evaluiert und entsprechend behandelt werden.
Klinik Innere Medizin und Kardiologie
Stadtspital Zürich Waid
Tièchestrasse 99
8037 Zürich
tobias.hoefflinghaus@stadtspital.ch
1. Berliner D et al. The differential diagnosis of dyspnea. Dtsch Arztebl Int 2016; 113: 834–45.
2. McDonagh T et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;00,1-128.
3. Reddy Y et al. A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation 2018;138,861-870.
4. Velazquez E et al. Coronary-bypass Surgery in Patients with Ischemic Cardiomyopathy. N Engl J Med 2016;374,1511-1520.
5. Perera D et al. Percutaneous revascularization for Ischemic Left Ventricular Dysfunction. N Engl J Med 2022; epub ahead of print, online 27.08.2022.
6. Maurer M et al. Tafamidis Treatment for Patients with Transthyretin Amyloid Cardiomyopathy. N Engl J Med 2018;379,1007-1016.
7. Solomon S et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022;387,1089-1098.
8. Anker S et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021;385,1451-1461.
9. Viau DM et al. The pathophysiology of acute hypertensive heart failure. Heart 2015;101:1861-67.
10. Williams B et al. 2018 ESC/ ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018;39,3021-3104.
11. Knuuti J et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2019;00,1-71.
12. Nakanishi R et al. Relationship of dyspnea vs. typical angina to coronary artery disease severity, burden, composition and location on coronary CT angiography. Atherosclerosis 2013;230,61-66.
13. Vahanian A et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2021;00,01-72.
14. Hindricks G et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020;00:1-125.
15. Marrouche NF et al. Catheter Ablation for Atrial Fibrillation with Heart Failure. N Engl J Med 2018;378:417-427.
16. Glikson M et al. 2021 ESC Guidelines on cardiac pacing and resynchronization therapy. Eur Heart J 2021;00,1-94.
17. Liu P et al. Left Bundle Branch Pacing: Current Knowledge and Future Prospects. Front Cardiovasc Med 2021:8,630399.
Therapeutische Umschau
- Vol. 80
- Ausgabe 6
- August 2023