- Konsequenzen von Chronodisruption auf Körpergewichtsregulation und Stoffwechsel
Zusammenfassung:
Die Prävalenz von Übergewicht und Adipositas hat weltweit ein dramatisches Ausmass erreicht. Parallel ist Schlafmangel ein Teil des modernen Lebensstils geworden, ebenso Schicht- und Nachtarbeit. Als Folge ist eine Chronodisruption, d. h., eine Veränderung von physiologischen Prozessen, die durch die innere Uhr gesteuert werden, fast alltäglich. Epidemiologische Daten zeigen, dass eine kurze, aber auch zu lange Schlafdauer mit einem erhöhten Risiko für Adipositas in Verbindung gebracht wird, ebenso wie Nachtschichtarbeit. Adipositas tritt häufig im Rahmen eines metabolischen Syndroms (MetS) auf, und auch hier gibt es Evidenz, dass sowohl kurzer als auch langer Schlaf das Risiko eines MetS steigern. Bislang ist nicht abschliessend geklärt, wie eine Chronodisruption dieses Risiko beeinflusst. Klinisch experimentelle Untersuchungen berichten über neuroendokrine und zirkadiane Mechanismen, und es hat sich u. a. gezeigt, dass Schlafmangel das Hunger fördernde Hormon Ghrelin sowie das subjektive Hungergefühl erhöht und den Leptinspiegel verringert. Schlafmangel steigert zudem den hedonischen Drang nach Nahrung und nahrungsbezogenen Belohnungssignalen. Durch präventive Massnahmen, sog. Schlafhygiene, kann einer Chronodisruption und so dem Risiko einer Adipositas entgegengewirkt werden. Inwieweit Smartwatches und Fitnesstracker, mit denen der Schlaf laut Herstellerangaben gemessen und analysiert werden kann, ein objektives Bild des Schlafs liefern, ist nicht ausreichend untersucht. Smartwatches und Fitnesstracker können jedoch die Aufmerksamkeit für das Thema Schlaf in der Gesellschaft erhöhen.
Einleitung
Der Nobelpreis für Medizin im Jahr 2017 wurde an Forscher verliehen, die die Funktionsweise der inneren Uhr enträtselt haben. Unsere innere Uhr ist dafür zuständig, Tag und Nacht den Biorhythmus von Lebewesen zu steuern. In unserer modernen Gesellschaft ist eine Chronodisruption, d. h., eine Veränderung von physiologischen Prozessen, die durch die innere Uhr gesteuert werden, fast alltäglich geworden. Das Themengebiet der Chronobiologie erlangte auch ausserhalb von Wissenschaft und Forschung einen grösseren Bekanntheitsgrad. Die Möglichkeit, seinen eigenen Schlaf über sogenannte Smart Watches oder Fitnesstracker zu erfassen, hat das Interesse der Gesellschaft am Schlaf-Wach-Rhythmus verstärkt.
Schlaf und Wachheit sind das Ergebnis einer zentralnervösen Integration von aktivierenden und schlafinduzierenden Signalen, welche von zirkadianen Signalen moduliert werden. Bereiche des Hypothalamus spielen in der Verarbeitung dieser zirkadianen Signale eine zentrale Rolle. Hervorzuheben hierbei ist, dass alle beteiligten Kerngebiete auch Schlüsselpositionen in der Regulation des menschlichen Energiestoffwechsels einnehmen und eine Dysregulation zu einer Gewichtszunahme führen kann. Im folgenden Artikel werden daher Zusammenhänge von Adipositas und Chronobiologie dargestellt sowie mögliche Ansätze für eine Prävention und Behandlung der Adipositas skizziert.
Adipositas
Die Adipositas stellt als chronische Erkrankung ein weltweites und zunehmendes gesundheitliches Problem dar. Die Prävalenz der Adipositas hat sich in insgesamt 73 Ländern verdoppelt und steigt in anderen Ländern seit 1980 stetig an (1). Insbesondere bei Kindern und Jugendlichen wurde eine Zunahme von Übergewicht und Adipositas festgestellt. Die gesundheitlichen Folgekomplikationen, die aus der Adipositas resultieren, betreffen mittlerweile mehr als zwei Milliarden Menschen weltweit. Ein hoher BMI war zudem weltweit für 4,0 Millionen Todesfälle verantwortlich. Dabei waren mehr als zwei Drittel der Todesfälle im Zusammenhang mit einem hohen BMI auf Herz-Kreislauf-Erkrankungen zurückzuführen. Weitere chronische Erkrankungen wie Diabetes mellitus, chronische Nierenerkrankungen, viele Krebserkrankungen und eine Reihe von Muskel-Skelett-Erkrankungen treten bei Vorliegen einer Adipositas gehäuft auf (2).
Die Ursachen der Adipositas sind multifaktoriell. Neben einer gesteigerten Aufnahme hochkalorischer Nahrung und Mangel an körperlicher Aktivität spielt die Schlafdauer und -qualität eine entscheidende Rolle (3). Eine gute Schlafqualität sowie eine ausreichende tägliche Schlafdauer stellen jedoch eine grosse Herausforderung in unserer heutigen modernen Gesellschaft dar. Parallel zum Anstieg der Adipositasprävalenz ist in den letzten Jahren auch die Zahl der Menschen zurückgegangen, die ausreichend, das heisst 7–9 Stunden, Schlaf pro Tag erreichen. Dabei geben viele Personen an, weniger als 6 Stunden Schlaf pro Nacht zu haben (4). Insbesondere für Schichtarbeiter/-innen ist es schwierig, einen regelmässigen und ausreichende Stunden Schlaf pro Tag zu erreichen. Schichtarbeit ist mittlerweile in der heutigen Gesellschaft fest integriert und beschränkt sich nicht mehr nur auf lebenswichtige Dienstleistungen wie Gesundheit, öffentliche Sicherheit und Schwerindustrie, sondern findet auch in anderen Bereichen der Güter- und Dienstleistungsproduktion statt. Dabei haben Arbeiter/-innen im Schichtdienst ein erhöhtes Risiko für die Entwicklung von Übergewicht und Adipositas (5).
Insgesamt verdeutlichen aber vor allem der rasche Anstieg der Prävalenz sowie die Komplikationen der Adipositas die Notwendigkeit von präventiven Massnahmen einer Gewichtszunahme (2).
Chronobiologie
Ein zirkadianer Rhythmus synchronisiert rund um die Uhr physiologische Vorgänge im Körper. Hormonelle und metabolische Parameter zeigen dabei eine mehr oder weniger ausgeprägte zirkadiane Rhythmik, die auch auf Verhaltensebene wie bei Aufmerksamkeit oder körperlicher Leistungsfähigkeit zu erkennen ist.
Schlaf und Wachheit sind das Ergebnis zentralnervöser Integration von aktivierenden und schlafinduzierenden Signalen, welche von zirkadianen Signalen moduliert werden. Dabei spielen hypothalame Kerngebiete in der Verarbeitung zirkadianer und schlafregulierender Signale eine zentrale Rolle. Auffallend ist dabei insbesondere, dass alle hierbei beteiligten Kerngebiete auch Schlüsselpositionen in der Regulation des menschlichen Energiestoffwechsels einnehmen, wie beispielsweise in der Regulation von Hunger und Sättigung.
Für die Generierung eines stabilen zirkadianen Rhythmus ist ein zentraler Schrittmacher, der Nucleus suprachiasmaticus (SCN), verantwortlich, der an der Basis des Hypothalamus lokalisiert ist. Afferenzen aus dem Tractus retinohypothalamicus, dessen Fasern aus dem Chiasma opticum zum SCN führen, ermöglichen eine stetige Synchronisierung dieser zentralen «inneren Uhr» mit regelmässig wiederkehrenden Umgebungsfaktoren, den sogenannten Zeitgebern, beispielsweise Licht. Weitere Beispiele für Zeitgeber sind die Nahrungsaufnahme oder körperliche Aktivität. Der SCN wiederum synchronisiert über endokrine Signale und das autonome Nervensystem die peripheren Uhren, die in nahezu allen Geweben nachweisbar sind.
Uhrengene regulieren in miteinander gekoppelten Rückkopplungsschleifen ihre eigene Transkription in einem 24-Stunden-Rhythmus. Heterodimere aus den Transkriptionsfaktoren CLOCK und BMAL1, die positiven Elemente dieser Rückkopplungsschleife, induzieren über regulatorische E-Box-Elemente die Transkription von Genen der negativen Faktoren wie Period 1 & 2 sowie Cryptochrome 1 & 2. Im Sinne eines negativen Feedbacks hemmen diese wiederum die Transkription von CLOCK und BMAL1, sodass es zu einer periodischen transkriptionellen Aktivierung und Deaktivierung im 24-Stunden-Takt kommt (6, 7).
Beim Chronotyp eines Menschen werden drei verschiedene Typen unterschieden, d. h. der Morgen-, der Abend- und der Mischtyp. Der Chronotyp bestimmt mit die Präferenz für Morgen- und Abendzeit und somit den individuellen Verlauf beispielsweise von Hormonspiegeln, Körpertemperatur, Schlaf- und Wachphasen sowie Leistungsvermögen (8, 9).
Zusammenhänge zwischen der inneren Uhr, Schlaf und einem modernen Lebensstil
Schlafmangel ist in allen Altersgruppen Teil des modernen Lebensstils geworden (10, 11). Die durchschnittliche Schlafdauer sank von 8–9 Stunden/Nacht im Jahr 1960 auf 7 Stunden/Nacht im Jahr 1995, und die Prävalenz von kurzer Schlafdauer wurde 2014 in den Vereinigten Staaten mit 45% angegeben, wobei ein Drittel der Erwachsenen in den USA weniger als 6 Stunden/Nacht schlief (12). In Deutschland gehören Schlafstörungen zu den häufigsten gesundheitlichen Beschwerden, und nach Datenerhebungen des Robert Koch- Instituts leiden 22% der 11–17-Jährigen an Schlafschwierigkeiten, während dies bei den 18–31-Jährigen fast 20% waren (9). Bei den Erwachsenen berichten ca. 25% über Schlafstörungen, und mehr als 10% erleben ihren Schlaf häufig oder dauerhaft als nicht erholsam (13).
Einfluss der inneren Uhr auf den Stoffwechsel: Kommt es zu einer Verschiebung von Phase und/oder Amplitude des zirkadianen Rhythmus wird von einer Chronodisruption gesprochen. Die Ursache kann dabei entweder in einer Störung synchronisierender Zeitgeber – z. B. Licht während der Schlafenszeit oder ein Zeitgebershift bei einer Transkontinentalreise – oder aber in einer Oszillationsstörung bzw. Störung in der Kommunikation der einzelnen Uhren liegen. Chronodisruption kann schliesslich zu pathologischen Veränderungen auf metabolischer, kardiovaskulärer, proliferativer und kognitiver Ebene führen.
Metabolische Konsequenzen von Chronodisruption
Basierend auf metaanalytischen Daten wird eine kurze Schlafdauer durchgängig mit einem erhöhten Risiko für Adipositas in Verbindung gebracht (14–16). Je kürzer die Schlafdauer, desto höher ist das Risiko für Adipositas. Laut der Metaanalyse von Itanie et al. (2007) ist das Risiko für Adipositas um 9% erhöht pro einstündiger Reduktion der Schlafdauer im Vergleich zu 7–8 Stunden Schlaf. Aber auch langer Schlaf ist mit einem erhöhten Risiko für Adipositas assoziiert, das laut einer Metaanalyse mit 13 Studien und über 300.000 Probanden bei 15% lag. Kurzer Schlaf erhöhte nach dieser Analyse das Risiko um 14% (17). Der Zusammenhang zwischen Schlafdauer und Adipositas scheint
u-förmig zu sein, was sowohl eine kurze als auch lange Schlafdauer betrifft.
Auch ein Kurzschlaf am Tag, als Powernap bezeichnet, ist Bestandteil der heutigen Gesellschaft geworden. Während ein Powernap mit verschiedenen gesundheitlichen Vorteilen in Verbindung gebracht wird, darunter einer Verbesserung der kognitiven Funktion, ist der Zusammenhang mit Übergewicht und Adipositas nicht eindeutig beschrieben. Die Ergebnisse einer Metaanalyse zeigen erste Evidenz, dass Powernapping das Risiko für Adipositas erhöht (18).
Das Vorliegen einer Adipositas tritt häufig im Rahmen eines metabolischen Syndroms (MetS) auf. Hierunter ist das Risiko für die Entwicklung eines Typ-2-Diabetes (T2D) sehr hoch. Auch hier gibt es Evidenz für einen Zusammenhang mit der Schlafdauer, der ebenfalls als u-förmig beschrieben werden kann, wobei kurzer und langer Schlaf das Risiko eines MetS um etwa 15% bzw. 19% erhöhten (17). Eine Metaanalyse mit insgesamt mehr als 480.000 Probanden zeigt, dass eine Schlafdauer von 7 bis 8 Stunden pro Tag mit der geringsten Prävalenz für T2D verbunden ist. Verglichen mit einer Schlafdauer von 7 Stunden pro Tag erhöhte jede einstündige Verkürzung der Schlafdauer das Risiko für T2D um 9% bei Personen, die weniger als 7 Stunden pro Tag schliefen und 14% für jeden einstündigen Anstieg der Schlafdauer bei Personen mit längerer Schlafdauer (19).
Eine zirkadiane Disruption wirkt sich negativ auf die Insulinsensitivität aus (20, 21). Insbesondere eine Unterbrechung oder Verkürzung des sogenannten Slow-wave Sleep, ein Schlafstadium, das hauptsächlich in der frühen Nachthälfte auftritt und mit Erholung verbunden ist, zeigte eine Assoziation zu einem erhöhten Risiko für die Entwicklung einer Insulinresistenz (22).
Eine zu kurze oder zu lange Schlafzeit ist ausserdem nicht nur mit negativen Auswirkungen auf den Metabolismus assoziiert. Eine lange Schlafdauer von mindestens neun Stunden oder mehr ist u. a. mit einem erhöhten Risiko für das Auftreten von Depression, chronischem Schmerz oder obstruktiver Schlafapnoe verbunden (23).
Schichtarbeit ist ein klassisches Beispiel für Chronodisruption. Einer Metaanalyse zufolge, die 28 Studien berücksichtigt, erhöht Nachtschichtarbeit das Risiko von Übergewicht und Adipositas um 23%. In Bezug auf die Regelmässigkeit der Nachtarbeit legen die Ergebnisse nahe, dass permanente Nachtarbeiter ein um 29% höheres Risiko als rotierende Schichtarbeiter besitzen (24). Die Energieaufnahme über 24 Stunden von Schichtarbeitern und Nichtschichtarbeitern scheint jedoch nicht unterschiedlich zu sein (25). Andere Faktoren müssen demzufolge für das bei Nachtarbeitern erhöhte Risiko für Adipositas mitverantwortlich sein.
Aufgrund zahlreicher Studien liegt eine hohe Evidenz vor, dass die Chronodisruption einen Risikofaktor für Gewichtszunahme, Adipositas und auch metabolische Begleiterkrankungen ist. Bisher ist aber nicht abschliessend geklärt, wie eine Chronodisruption dieses Risiko beeinflusst (12). Zugrunde liegende Mechanismen können in klinisch experimentellen Untersuchungen unter standardisierten Bedingungen untersucht werden, und Studien berichten über verschiedene neuroendokrine und zirkadiane Mechanismen, die den Metabolismus beeinflussen. Es hat sich u. a. gezeigt, dass bereits eine einzige Nacht ohne Schlaf das Hunger fördernde Hormon Ghrelin sowie insgesamt das subjektive Hungergefühl erhöhen kann (26). Nach einer längeren Phase mit Schlafmangel (6 Nächte mit jeweils nur 4 Stunden Schlaf) zeigten sich zudem verringerte Leptinspiegel (27). Leptin ist ein Hormon, das von weissen Adipozyten produziert wird und den Appetit zügelt. Sinken die Leptinspiegel im Blut, kann es daher zu einem gesteigerten Appetit kommen (28). Die Verringerung des Leptinanstiegs ist auch quantitativ mit einem Anstieg der abendlichen Cortisolspiegel einhergegangen, was die Existenz von Wechselwirkungen zwischen der physiologischen Regulierung von Leptin und Cortisol unterstützt. Dieser negative Zusammenhang zwischen Veränderungen von Leptin und Cortisol während der Schlafbeschränkung könnte ausserdem die gut dokumentierte unterdrückende Wirkung von Leptin auf die Hypothalamus-Hypophysen-Nebennieren-Aktivität widerspiegeln (27, 29). Neben den Veränderungen von Hormonkonzentrationen zeigen sich auch unterschiedlich stark ausgeprägte Aktivitäten bestimmter Gehirnregionen nach Schlafmangel. Bei gesunden Probanden mit eingeschränktem Schlaf konnte eine erhöhte Aktivität von bestimmten Gehirnarealen gesehen werden, wenn ihnen Bilder von schmackhaften und hochkalorischen Lebensmitteln im MRT gezeigt wurden. Diese bestimmten Gehirnareale wie das Putamen, der Nucleus accumbens, der Thalamus und der präfrontale Kortex sind entscheidend für die Regulierung von Hunger, Appetit und Belohnung zuständig (28, 30).
Weiterhin steigert Schlafmangel den hedonischen Drang nach Nahrung und erhöht die nahrungsbezogenen Belohnungssignale. Hinzu kommt, dass die durch Schlafeinschränkungen verursachte längere Wachheit mit einem Anstieg des Grundenergieverbrauchs und einer anschliessenden Überkompensation der Energieaufnahme einhergeht, was zu einer positiven Energiebilanz und Gewichtszunahme führt (31, 32). Passend dazu zeigte sich in einer klinisch-experimentellen Studie, dass es nach vier Nächten mit zunehmender Schlafverringerung zu einer Gewichtszunahme von 0,4 kg kommt (33). In einer weiteren Studie, bei der die teilnehmenden Probanden fünf Nächte mit verkürztem Schlaf hatten, lag die Gewichtszunahme sogar bei durchschnittlich 0,8 kg (34).
In einer klinisch-experimentellen Studie hat sich ausserdem gezeigt, dass auch der Zeitpunkt des verkürzten Schlafs eine Rolle in der Auswirkung auf den Metabolismus spielt. So waren Ghrelin, Hunger- und Appetitgefühle sowie das Verlangen nach Nahrung bei Schlafverlust in der späten Nacht (von 2.15 bis 6.45 Uhr) erhöht, nicht jedoch bei Schlafverlust in der frühen Nacht (von 22.30 bis 3 Uhr), während Leptin vom Zeitpunkt des Schlafverlusts unbeeinflusst blieb (35).
Nicht nur die Quantität, sondern auch die Qualität des Schlafs scheint den Glukosestoffwechsel zu beeinflussen. So führte eine selektive Unterdrückung des Tiefschlafs durch akustische Signale bereits nach drei Nächten zu einer verringerten Glukosetoleranz und Insulinsensitivität bei gesunden Probanden, dieses ohne Veränderung der absoluten Schlafdauer (36).
Ein weiteres Problem für den Stoffwechsel stellt die nächtliche Einwirkung von künstlichem Licht aus verschiedenen Lichtquellen dar. Dies kommt in unserer modernen Gesellschaft häufig vor und gilt zudem als globales Problem. Mäuse zeigten beispielsweise eine Gewichtszunahme und unregulierte Fressgewohnheiten, wenn sie vier Wochen lang hellem (150 Lux) oder schwachem Licht (5 Lux) über 24 Stunden hinweg ausgesetzt waren. Ausserdem verschlechterte sich die Glukosetoleranz im Vergleich zu denen, die im Dunkeln gehalten wurden. Die Effekte waren ausgeprägter bei den Mäusen, die hellem Licht statt schwachem Licht ausgesetzt waren (37). Auch eine Studie an gesunden Männern konnte zeigen, dass bereits leichtes und gedämpftes Licht während zwei Nächten hintereinander die Schlafarchitektur veränderte, ohne dabei Auswirkungen auf den Glukosestoffwechsel zu induzieren (38).
Nicht nur das erhöhte Risiko für die Entwicklung einer Adipositas steht mit einer veränderten Chronobiologie in Zusammenhang. Auch eine Assoziation mit einem erhöhten Risiko für einen Typ-2-Diabetes-mellitus (T2D) konnte in einigen Studien gezeigt werden. Eine verkürzte Schlafdauer von 4 Stunden/Nacht über 6 Tage führte bei gesunden Personen bereits zu einer prädiabetischen Stoffwechsellage in einem intravenösen Glukosetoleranztest (39). Eine weitere Studie konnte eine eingeschränkte Glukosetoleranz sowie eine reduzierte Insulinsensitivität nach zwei Tagen mit nur vier Stunden Schlaf messen (40). Auch der Zeitpunkt der Schlafbeschränkung spielt für den Glukosemetabolismus eine entscheidende Rolle. Es hat sich gezeigt, dass, obwohl Schlafentzug die Insulinsensitivität unabhängig vom nächtlichen Zeitpunkt verringert, der Schlafverlust am frühen Morgen die Aktivität der α-Zellen und der Hypothalamus-Hypophysen-Nebennieren-Achse stärker als der Schlafverlust in der ersten Nachthälfte beeinträchtigt (41).
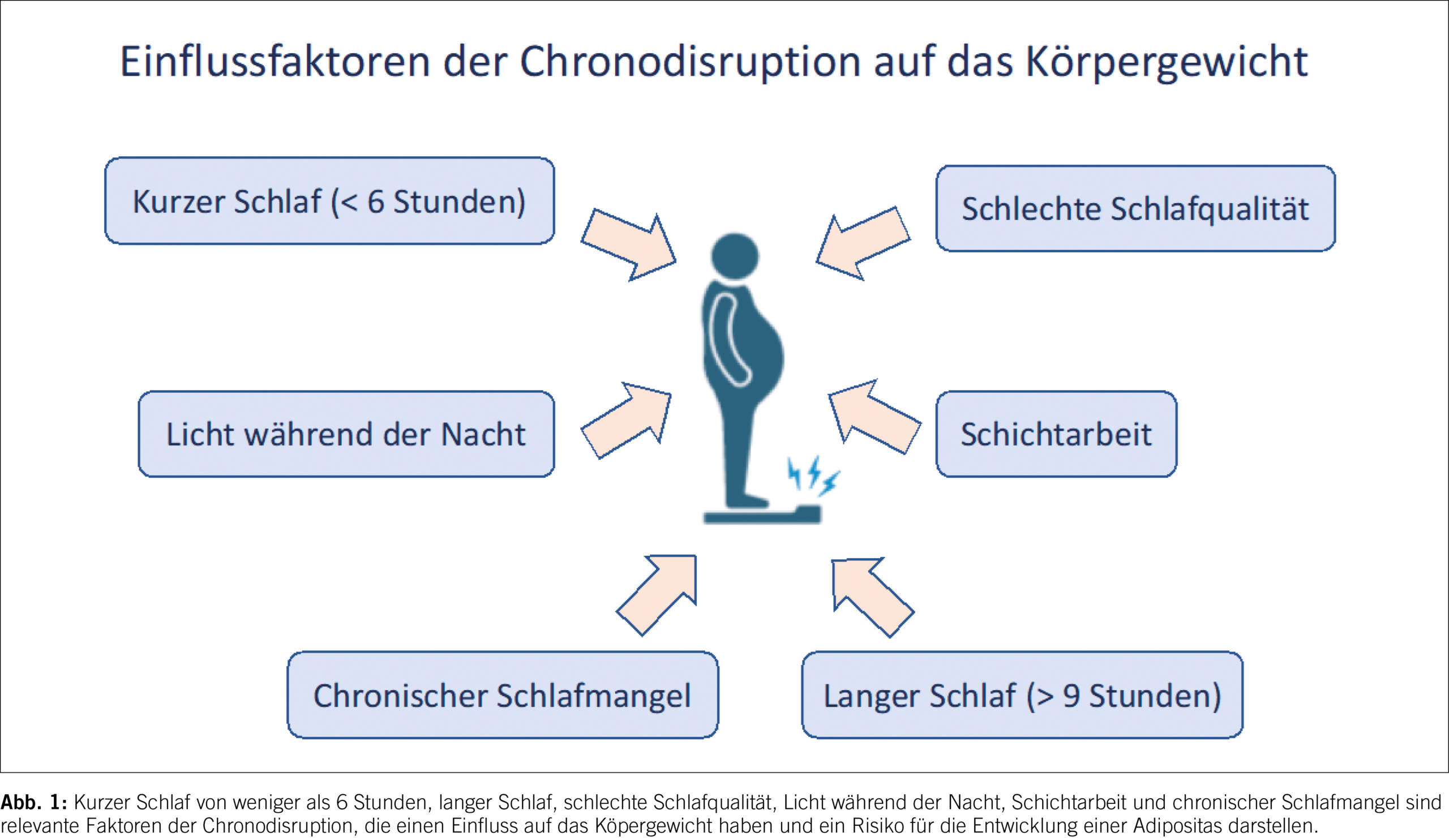
Die folgende Abbildung fasst die relevanten Faktoren der Chronodisruption, die einen Einfluss auf das Körpergewicht haben und ein Risiko für die Entwicklung einer Adipositas darstellen, zusammen (Abb. 1).
Präventive Massnahmen zur Vermeidung von Chronodisruption
Bewegung und körperliches Training: Körperliche Aktivität nimmt in der Adipositastherapie und -prävention eine wichtige Rolle ein, obwohl der energetische Beitrag nur eine geringere Bedeutung hat. Körperliche Aktivität senkt jedoch das Morbiditäts- und Mortalitätsrisiko. Insbesondere in Hinsicht auf eine oftmals geringe Therapieadhärenz bei Bewegung und Training ist es umso wichtiger, ein optimiertes Trainingsprogramm individuell für den Patienten zu erstellen. In Bezug auf den zirkadianen Rhythmus gibt es erste Evidenz, dass das Timing von Training, u. a. vormittags versus nachmittags, die Response beispielsweise in Bezug auf den Glukosemetabolismus beeinflusst (42). Momentan ist jedoch eine A-priori-Identifikation von Personen hinsichtlich des optimalen Trainingszeitpunktes nicht möglich. Hier bedarf es intensiver weiterer Forschungsbestrebungen, um einerseits die metabolischen Effekte von Timing von Training zu quantifizieren und um andererseits Kriterien zu entwickeln, die optimale Trainingszeit vor Therapiebeginn festlegen zu können.
Fitnesstracker zur Beurteilung von Schlaf
Gadgets wie Smartwatches und Fitnesstracker haben Funktionen, mit denen der eigene Schlaf unter den Alltagsbedingungen gemessen und analysiert werden kann. Die Daten werden dann meist in einer App oder teilweise direkt am Display des Gerätes abgelesen. Umfragen zufolge nutzen immer mehr Menschen diese Funktion. Inwieweit dies zu einem «gesünderen» Schlaf führt, ist jedoch nicht bekannt. Smartwatches können das Bewusstsein dafür schärfen, dass der Schlaf eine sehr wichtige biologische Funktion erfüllt. Eine Vielzahl der Gadgets sind allerdings noch ungenau, und weder Qualität des Schlafs noch Schlafmenge können richtig gemessen werden. Ihre Technik beruht auf Beschleunigungsmesser, Elektrokardiografie oder Temperatur, einzeln oder in Kombination. Allerdings gibt es Bestrebungen, die der Analyse zugrunde liegenden Algorithmen zu optimieren und so beispielsweise die verschiedenen Schlafstadien erfassen zu können. Aber auch aufgrund der Zeitspanne, die zwischen Experimenten im Rahmen einer wissenschaftlichen Studie und der Publikation der Daten liegt, können diese Ergebnisse kaum keinen aktuellen Stand zu der Genauigkeit der Smartwatches widerspiegeln (43–46).
Polymorphismen von Uhrengenen, Adipositas und Gewichtsreduktion
Genetische Varianten (d. h. Einzelnukleotidpolymorphismen, SNPs) von Uhrengenen scheinen im Zusammenhang mit dem Risiko für Adipositas (47) und der Schlafdauer zu stehen (48, 49). Es wurden bereits über 300 SNPs von Uhrengenen in genomweiten Assoziationsstudien mit dem Chronotyp in Verbindung gebracht (50). Einen Zusammenhang zum Risiko für Adipositas scheinen beispielsweise SNPs rs3749474, rs1801260 des CLOCK-Gens zu zeigen (49). In Bezug auf eine Gewichtsabnahme im Rahmen eines Interventionsprogramms, welches auf der Mittelmeerdiät basierte, wurde diese durch den SNP des CLOCK-Gens rs1801260 zusätzlich beeinflusst. Zudem wird berichtet, dass die Personen, die als «Spätesser» charakterisiert wurden, weniger Körpergewicht abnahmen als die «Frühesser» (51). Ein Zusammenhang zwischen SNPs des CLOCK-Gens, Adipositas und der langfristigen Gewichtsreduktion sechs Jahre nach einer bariatrischen Operation wurde bei 375 Patienten mit morbider Adipositas und 230 Kontrollpersonen untersucht. Das G-Allel der rs1801260-Variante des CLOCK-Gens zeigte einen protektiven Effekt gegenüber Adipositas. Postoperativ war der Gewichtsverlust höher sowie die Gewichtszunahme geringer bei Trägern des A-Allels. Bei Personen, die homozygot für das T-Allel vom CLOCK-Gen rs3749474 waren, lag Assoziation zur Adipositas vor, und sechs Jahre nach einer bariatrischen Operation wurde ein geringer Gewichtsverlust und eine deutlich grössere Gewichtszunahme festgestellt (52).
Ausblick
Eine Optimierung oder ein Erhalt des zirkadianen Rhythmus kann zur Prävention bzw. Therapie von Adipositas beitragen. Einfache Massnahmen können zu einem «guten Schlaf» beitragen, wie adäquate Schlafdauer und adäquater Schlaf-Wach-Rhythmus, optimierte Umgebungsbedingungen wie Vermeidung von Licht und Lärm sowie die Vermeidung von ausgeprägtem Powernapping. Inwieweit ein Schlaftracking mit handelsüblichen Smartwatches eine Möglichkeit bietet, den Schlaf zu optimieren, ist derzeit noch nicht geklärt.
Therapiestrategien in der Ernährung sollten nicht nur die Kalorienaufnahme und Makronährstoffverteilung – wie klassisch üblich – berücksichtigen, sondern auch den Zeitpunkt der Nahrungsaufnahme. Dies gilt auch für das körperliche Training, wobei hier noch umfangreicher Forschungsbedarf besteht.
Medizinische Klinik, Universität zu Lübeck
23562 Lübeck
Deutschland
Center of Brain, Behavior and Metabolism
Universität zu Lübeck
Marie Curie Strasse, Haus 66
D-23562 Lübeck
britta.wilms@uni-luebeck.de
Die Autorinnen haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1. Friedrich MJ (2017) Global Obesity Epidemic Worsening. JAMA 318(7):603. https://doi.org/10.1001/jama.2017.10693
2. The GBD 2015 Obesity Collaborators (2017) Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N Engl J Med 377(1):13–27. https://doi.org/10.1056/NEJMoa1614362
3. Schmid SM, Hallschmid M, Schultes B (2015) The metabolic burden of sleep loss. Lancet Diabetes Endocrinol 3(1):52–62. https://doi.org/10.1016/S2213-8587(14)70012-9
4. Knutson KL, Van Cauter E (2008) Associations between sleep loss and increased risk of obesity and diabetes. Ann N Y Acad Sci 1129:287–304. https://doi.org/10.1196/annals.1417.033
5. Brum MCB, Dantas Filho FF, Schnorr CC, Bertoletti OA, Bottega GB, Da Costa Rodrigues T (2020) Night shift work, short sleep and obesity. Diabetol Metab Syndr 12(1):13. https://doi.org/10.1186/s13098-020-0524-9
6. de Assis LVM, Oster H (2021) The circadian clock and metabolic homeostasis: entangled networks. Cell Mol Life Sci 78(10):4563–4587. https://doi.org/10.1007/s00018-021-03800-2
7. Pilorz V, Helfrich-Förster C, Oster H (2018) The role of the circadian clock system in physiology. Pflugers Arch 470(2):227–239. https://doi.org/10.1007/s00424-017-2103-y
8. Roenneberg T, Wirz-Justice A, Merrow M (2003) Life between clocks: daily temporal patterns of human chronotypes. J Biol Rhythms 18(1):80–90. https://doi.org/10.1177/0748730402239679
9. Facer-Childs ER, Campos BM, Middleton B, Skene DJ, Bagshaw AP (2019) Circadian phenotype impacts the brain’s resting-state functional connectivity, attentional performance, and sleepiness. Sleep 42(5):zsz033. https://doi.org/10.1093/sleep/zsz033
10. Du M, Liu M, Wang Y, Qin C, Liu J (2024) Global burden of sleep disturbances among older adults and the disparities by geographical regions and pandemic periods. SSM Popul Health 25:101588. https://doi.org/10.1016/j.ssmph.2023.101588
11. Gradisar M, Gardner G, Dohnt H (2011) Recent worldwide sleep patterns and problems during adolescence: a review and meta-analysis of age, region, and sleep. Sleep Med 12(2):110–118. https://doi.org/10.1016/j.sleep.2010.11.008
12. Van Cauter E, Knutson KL (2008) Sleep and the epidemic of obesity in children and adults. Eur J Endocrinol 159 Suppl 1(S1):S59-66. https://doi.org/10.1530/EJE-08-0298
13. Penzel T, Robert Koch-Institut (2005) Schlafstörungen. Robert Koch-Inst, Berlin
14. Itani O, Jike M, Watanabe N, Kaneita Y (2017) Short sleep duration and health outcomes: a systematic review, meta-analysis, and meta-regression. Sleep Med 32:246–256. https://doi.org/10.1016/j.sleep.2016.08.006
15. Zhou Q, Zhang M, Hu D (2019) Dose-response association between sleep duration and obesity risk: a systematic review and meta-analysis of prospective cohort studies. Sleep Breath 23(4):1035–1045. https://doi.org/10.1007/s11325-019-01824-4
16. Bacaro V, Ballesio A, Cerolini S, et al (2020) Sleep duration and obesity in adulthood: An updated systematic review and meta-analysis. Obes Res Clin Pract 14(4):301–309. https://doi.org/10.1016/j.orcp.2020.03.004
17. Che T, Yan C, Tian D, Zhang X, Liu X, Wu Z (2021) The Association Between Sleep and Metabolic Syndrome: A Systematic Review and Meta-Analysis. Front Endocrinol 12:773646. https://doi.org/10.3389/fendo.2021.773646
18. Cai Z, Yang Y, Zhang J, Liu Y (2023) The relationship between daytime napping and obesity: a systematic review and meta-analysis. Sci Rep 13(1):12124. https://doi.org/10.1038/s41598-023-37883-7
19. Shan Z, Ma H, Xie M, et al (2015) Sleep duration and risk of type 2 diabetes: a meta-analysis of prospective studies. Diabetes Care 38(3):529–537. https://doi.org/10.2337/dc14-2073
20. Anothaisintawee T, Reutrakul S, Van Cauter E, Thakkinstian A (2016) Sleep disturbances compared to traditional risk factors for diabetes development: Systematic review and meta-analysis. Sleep Med Rev 30:11–24. https://doi.org/10.1016/j.smrv.2015.10.002
21. Sondrup N, Termannsen A-D, Eriksen JN, et al (2022) Effects of sleep manipulation on markers of insulin sensitivity: A systematic review and meta-analysis of randomized controlled trials. Sleep Medicine Reviews 62:101594. https://doi.org/10.1016/j.smrv.2022.101594
22. Johnson JM, Durrant SJ, Law GR, Santiago J, Scott EM, Curtis F (2022) The effect of slow-wave sleep and rapid eye-movement sleep interventions on glycaemic control: a systematic review and meta-analysis of randomised controlled trials. Sleep Medicine 92:50–58. https://doi.org/10.1016/j.sleep.2022.03.005
23. Chaput J-P, Dutil C, Featherstone R, et al (2020) Sleep duration and health in adults: an overview of systematic reviews. Appl Physiol Nutr Metab 45(10 (Suppl. 2)):S218–S231. https://doi.org/10.1139/apnm-2020-0034
24. Sun M, Feng W, Wang F, et al (2018) Meta-analysis on shift work and risks of specific obesity types. Obesity Reviews 19(1):28–40. https://doi.org/10.1111/obr.12621
25. Bonham MP, Bonnell EK, Huggins CE (2016) Energy intake of shift workers compared to fixed day workers: A systematic review and meta-analysis. Chronobiology International 33(8):1086–1100. https://doi.org/10.1080/07420528.2016.1192188
26. Schmid SM, Hallschmid M, Jauch-Chara K, Born J, Schultes B (2008) A single night of sleep deprivation increases ghrelin levels and feelings of hunger in normal-weight healthy men. Journal of Sleep Research 17(3):331–334. https://doi.org/10.1111/j.1365-2869.2008.00662.x
27. Spiegel K, Leproult R, L’hermite-Balériaux M, Copinschi G, Penev PD, Van Cauter E (2004) Leptin levels are dependent on sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol, and thyrotropin. J Clin Endocrinol Metab 89(11):5762–5771. https://doi.org/10.1210/jc.2004-1003
28. Chaput J-P, McHill AW, Cox RC, et al (2023) The role of insufficient sleep and circadian misalignment in obesity. Nat Rev Endocrinol 19(2):82–97. https://doi.org/10.1038/s41574-022-00747-7
29. Flier JS (2004) Obesity wars: molecular progress confronts an expanding epidemic. Cell 116(2):337–350. https://doi.org/10.1016/s0092-8674(03)01081-x
30. Benedict C, Brooks SJ, O’Daly OG, et al (2012) Acute sleep deprivation enhances the brain’s response to hedonic food stimuli: an fMRI study. J Clin Endocrinol Metab 97(3):E443-447. https://doi.org/10.1210/jc.2011-2759
31. Broussard JL, Van Cauter E (2016) Disturbances of sleep and circadian rhythms: novel risk factors for obesity. Curr Opin Endocrinol Diabetes Obes 23(5):353–359. https://doi.org/10.1097/MED.0000000000000276
32. Bromley LE, Booth JN, Kilkus JM, Imperial JG, Penev PD (2012) Sleep restriction decreases the physical activity of adults at risk for type 2 diabetes. Sleep 35(7):977–984. https://doi.org/10.5665/sleep.1964
33. Bosy-Westphal A, Hinrichs S, Jauch-Chara K, et al (2008) Influence of Partial Sleep Deprivation on Energy Balance and Insulin Sensitivity in Healthy Women. Obes Facts 1(5):266–273. https://doi.org/10.1159/000158874
34. Markwald RR, Melanson EL, Smith MR, et al (2013) Impact of insufficient sleep on total daily energy expenditure, food intake, and weight gain. Proc Natl Acad Sci USA 110(14):5695–5700. https://doi.org/10.1073/pnas.1216951110
35. Meyhöfer S, Chamorro R, Hallschmid M, et al (2023) Late, but Not Early, Night Sleep Loss Compromises Neuroendocrine Appetite Regulation and the Desire for Food. Nutrients 15(9):2035. https://doi.org/10.3390/nu15092035
36. Tasali E, Leproult R, Ehrmann DA, Van Cauter E (2008) Slow-wave sleep and the risk of type 2 diabetes in humans. Proceedings of the National Academy of Sciences 105(3):1044–1049
37. Fonken LK, Workman JL, Walton JC, et al (2010) Light at night increases body mass by shifting the time of food intake. Proc Natl Acad Sci USA 107(43):18664–18669. https://doi.org/10.1073/pnas.1008734107
38. Chamorro R, Wilms B, Holst A, et al (2021) Acute mild dim light at night slightly modifies sleep but does not affect glucose homeostasis in healthy men. Sleep Med 84:158–164. https://doi.org/10.1016/j.sleep.2021.05.038
39. Spiegel K, Leproult R, Van Cauter E (1999) Impact of sleep debt on metabolic and endocrine function. The Lancet 354(9188):1435–1439. https://doi.org/10.1016/S0140-6736(99)01376-8
40. Schmid SM, Hallschmid M, Jauch-Chara K, et al (2011) Disturbed Glucoregulatory Response to Food Intake After Moderate Sleep Restriction. Sleep 34(3):371–377. https://doi.org/10.1093/sleep/34.3.371
41. Wilms B, Chamorro R, Hallschmid M, et al (2019) Timing Modulates the Effect of Sleep Loss on Glucose Homeostasis. The Journal of Clinical Endocrinology & Metabolism 104(7):2801–2808. https://doi.org/10.1210/jc.2018-02636
42. Kirchner H, Weisner L, Wilms B (2023) When should I run-the role of exercise timing in metabolic health. Acta Physiol (Oxf) 237(4):e13953. https://doi.org/10.1111/apha.13953
43. Pires GN, Arnardóttir ES, Bailly S, McNicholas WT (2024) Guidelines for the development, performance evaluation and validation of new sleep technologies (DEVSleepTech guidelines) – a protocol for a Delphi consensus study. J Sleep Res e14163. https://doi.org/10.1111/jsr.14163
44. Roomkham S, Lovell D, Cheung J, Perrin D (2018) Promises and Challenges in the Use of Consumer-Grade Devices for Sleep Monitoring. IEEE Rev Biomed Eng 11:53–67. https://doi.org/10.1109/RBME.2018.2811735
45. Song T-A, Chowdhury SR, Malekzadeh M, et al (2023) AI-Driven sleep staging from actigraphy and heart rate. PLoS One 18(5):e0285703. https://doi.org/10.1371/journal.pone.0285703
46. Rentz LE, Ulman HK, Galster SM (2021) Deconstructing Commercial Wearable Technology: Contributions toward Accurate and Free-Living Monitoring of Sleep. Sensors (Basel) 21(15):5071. https://doi.org/10.3390/s21155071
47. Molina-Montes E, Rodríguez-Barranco M, Ching-López A, et al (2022) Circadian clock gene variants and their link with chronotype, chrononutrition, sleeping patterns and obesity in the European prospective investigation into cancer and nutrition (EPIC) study. Clinical Nutrition 41(9):1977–1990. https://doi.org/10.1016/j.clnu.2022.07.027
48. Allebrandt KV, Teder-Laving M, Akyol M, et al (2010) CLOCK gene variants associate with sleep duration in two independent populations. Biol Psychiatry 67(11):1040–1047. https://doi.org/10.1016/j.biopsych.2009.12.026
49. Valladares M, Obregón AM, Chaput J-P (2015) Association between genetic variants of the clock gene and obesity and sleep duration. J Physiol Biochem 71(4):855–860. https://doi.org/10.1007/s13105-015-0447-3
50. Jones SE, Lane JM, Wood AR, et al (2019) Genome-wide association analyses of chronotype in 697,828 individuals provides insights into circadian rhythms. Nat Commun 10(1):343. https://doi.org/10.1038/s41467-018-08259-7
51. Garaulet M, Ordovás JM, Madrid JA (2010) The chronobiology, etiology and pathophysiology of obesity. Int J Obes 34(12):1667–1683. https://doi.org/10.1038/ijo.2010.118
52. Torrego-Ellacuría M, Barabash A, Matía-Martín P, et al (2022) Influence of CLOCK Gene Variants on Weight Response after Bariatric Surgery. Nutrients 14(17):3472. https://doi.org/10.3390/nu14173472
Therapeutische Umschau
- Vol. 81
- Ausgabe 3
- Juni 2024