- Medizinische Interventionen zur Adipositastherapie
Zusammenfassung
Adipositas ist eine chronische Erkrankung, welche durch eine erhöhte Körperfettmasse und gestörte Fettgewebsfunktion charakterisiert ist und deren Pathogenese auf einer neurobiologischen Regulationsstörung der Energiehomöostase basiert. Primäres Ziel der medizinischen Adipositastherapie ist es, die pathologisch erhöhte Körperfettmasse zu reduzieren und dadurch Folgeerkrankungen zu verhindern und Komorbiditäten zu verbessern. In diesem Sinn stellt die bariatrisch-metabolische Chirurgie derzeit die effektivste Adipositastherapie dar. Neue Medikamente, welche im Wesentlichen auf einem GLP-1-Rezeptoragonismus basieren, erlauben mittlerweile auch eine immer wirksamere pharmakologische Therapie. Dabei ist es wichtig zu wissen, dass sowohl die bariatrisch-metabolische Chirurgie als auch die pharmakologische Adipositastherapie direkte Effekte auf die zentralnervöse Regulation der Energiehomöostase sowie insbesondere von Hunger und Appetit ausüben und damit pathogenetisch kausale Therapien darstellen. In unserer Übersicht beleuchten wir die genannten medizinischen Interventionen zur Adipositastherapie und stellen sie in den Kontext eines pathogenetischen Krankheitskonzepts.
Einleitung
Adipositas ist eine chronische Erkrankung, welche pathogenetisch auf einer neurobiologischen Regulationsstörung basiert. Die Morbidität der Erkrankung definiert sich einerseits durch das Ausmass der Fettgewebsdysfunktion, anderseits durch die ausgeprägte soziale Stigmatisierung der Erkrankung und der Betroffenen. Während sich die Gesundheitssysteme meist auf die Behandlung der Begleit- und Folgeerkrankungen der Adipositas fokussieren, adressiert die eigentliche medizinische Adipositastherapie die zugrunde liegende Pathophysiologie der Erkrankung, indem sie zentralnervöse Regulationsprozesse der Energiehomöostase und insbesondere das Hunger- und Appetitempfinden beeinflusst. Dabei hat sich die bariatrisch-metabolische Chirurgie mittlerweile als effektivste Therapie der Adipositas etabliert, da sie unter anderem die Morbidität und Mortalität der Erkrankung langfristig massiv reduziert. Zudem gewinnen neue pharmakologische Therapien, welche aktuell im Wesentlichen auf eine Verstärkung des physiologischen Glucagon-like-Peptid-1-(GLP-1-) Signals basieren, als zusätzliche therapeutische Option der Adipositastherapie an Bedeutung. In unserem Artikel geben wir eine praxisorientierte Übersicht über die medizinischen Interventionen (pharmakologisch/chirurgisch) zur Behandlung der Adipositas und stellen sie in den Kontext der Pathogenese der Erkrankung.
Der Mythos, der einer effektiven Adipositastherapie im Wege steht
Obgleich wissenschaftlich seit Langem widerlegt, hält sich hartnäckig der weitverbreitete Mythos, dass das Köpergewicht und die damit verbundene Körperfettmasse einer willentlichen Kontrolle unterliegt. Dabei sind sich die Fachleute und Spezialist/-innen mittlerweile einig, dass das hyperphagische Essverhalten der betroffenen Patient/-innen nicht Ursache, sondern vielmehr das Leitsymptom der Adipositaserkrankung darstellt. Vereinfacht kann man also sagen, dass die betroffenen Patient/-innen nicht übergewichtig sind, weil sie zu viel essen, sondern sie essen zu viel, weil sie an Adipositas erkrankt sind. Folgerichtig haben sich kognitive Therapieansätze, wie beispielsweise Ernährungsberatung, Verhaltens- und Psychotherapie sowie Bewegungs- und Trainingstherapien, zwar als potenziell hilfreich in der Behandlung von Menschen mit Adipositas erwiesen, jedoch sind sie meist nicht effektiv genug, um die pathologisch erhöhte Fettmasse, also das krankheitsdefinierende Charakteristikum, dauerhaft zu reduzieren. Entsprechend sind diese klassischen Therapieansätze bestenfalls als supportiv und komplementär, jedoch nicht als alleinstehende Behandlung der Erkrankung anzusehen. Deshalb dürfen sie keine Hürde darstellen, die den Einsatz effektiverer und pathogenetisch kausaler Therapieansätze verhindert. Mit anderen Worten, ihr Einsatz respektive die Inanspruchnahme entsprechender Therapieangebote durch betroffene Personen darf keine Grundvoraussetzung für den Einsatz von evidenzbasierten, medizinischen Interventionen zur effektiven Behandlung der Erkrankung darstellen. Bei vielen anderen chronischen Erkrankungen, wie beispielsweise Diabetes mellitus, arterielle Hypertonie, koronare Herzkrankheit oder chronisch obstruktive Lungenerkrankung, wissen wir ebenfalls, dass behaviorale Therapieansätze positive Effekte auf den Krankheitsverlauf haben können, würden jedoch niemals auf die Idee kommen, betroffenen Personen bei unzureichendem Nutzen dieser Möglichkeiten eine Therapie mit wissenschaftlich nachgewiesener Effektivität vorzuenthalten. Genau dies ist jedoch im Fall der Adipositasbehandlung leider immer noch medizinischer Alltag.
Adipositas – eine zentralnervöse Regulationsstörung
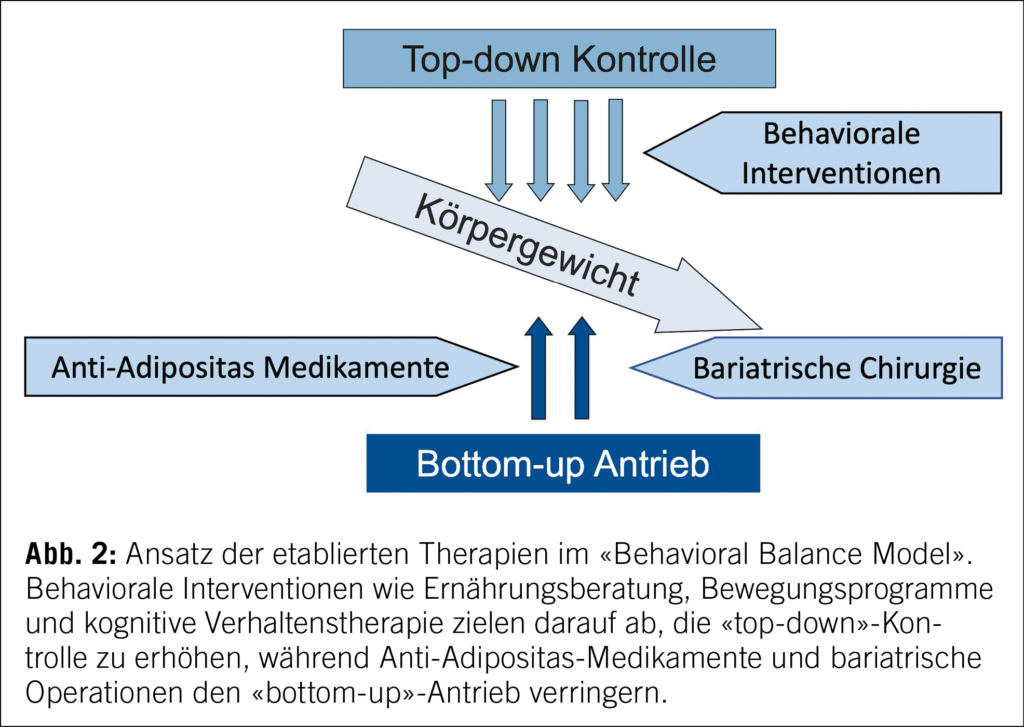
Menschen mit Adipositas leiden unter einer zentralnervösen Regulationsstörung der Energiehomöostase, insbesondere der Steuerung des Hunger- und Appetitempfindens. Dabei spielt eine unzureichende Wirkung neuroendokriner Feedbacksignale aus der Peripherie, wie beispielsweise Leptin und Insulin, im Sinne einer zentralnervösen Leptin-/Insulin-Resistenz eine bedeutende Rolle. Daraus resultierend ergibt sich bei Menschen mit Adipositas im Vergleich zu Nichtbetroffenen gemäss dem «Behavioral Balance Model» (1) ein physiologisch erhöhter «bottom-up»-Antrieb zur Gewichtzunahme (Abb. 1).
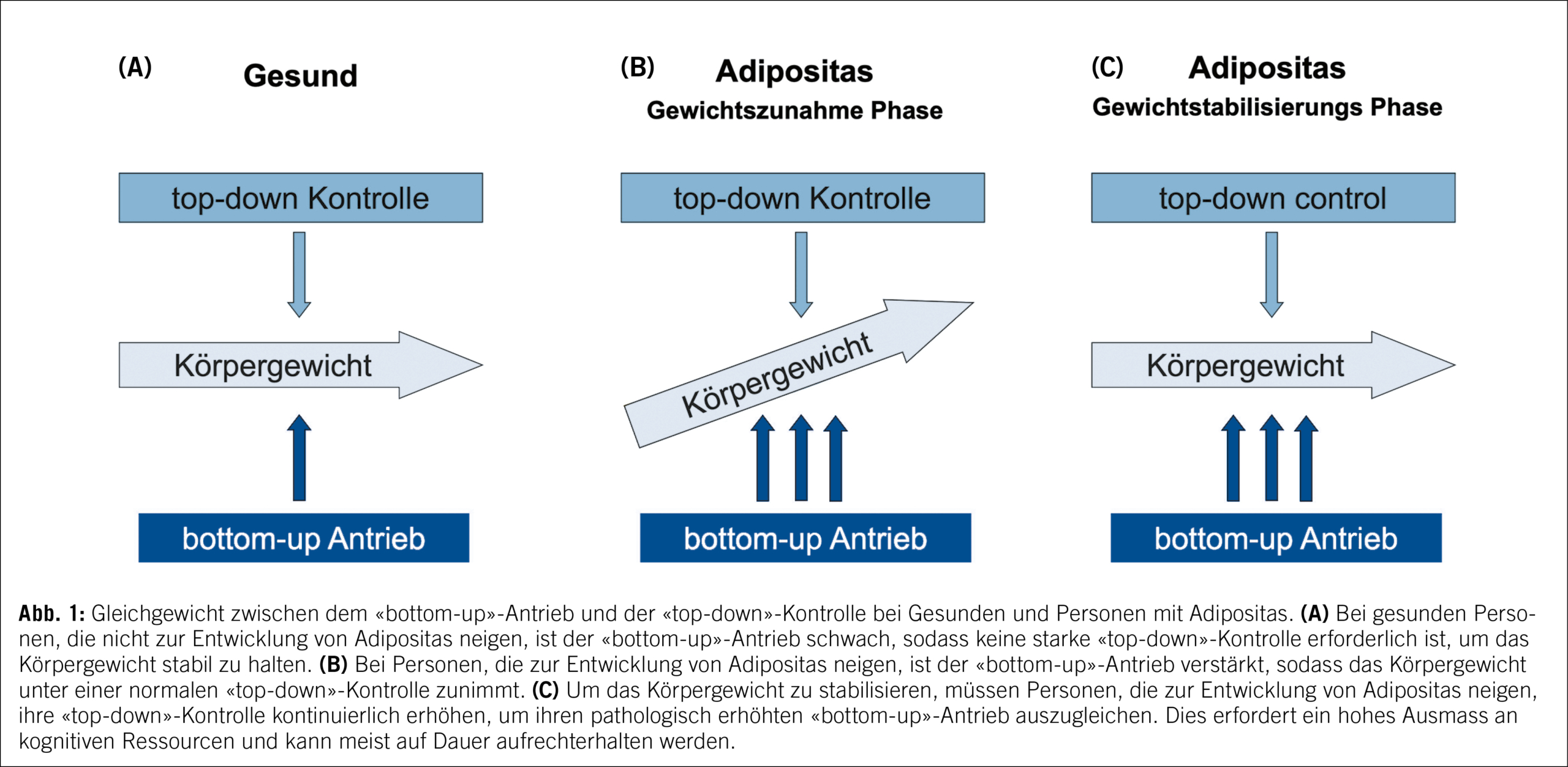
Um einen progredienten Gewichtsanstieg zu verhindern, müssen Menschen mit Adipositas daher also einen deutlich erhöhten kognitiven («top-down») «Aufwand» betreiben, um ihre Ernährung sowie ihr Bewegungsverhalten willentlich zu kontrollieren. Leider erhöht sich bei einer solchen forcierten Gewichtsreduktion durch Restriktion der Energiezufuhr («Diät») der «bottom-up»-Antrieb im Sinne einer neuroendokrinen Gegenregulation immer mehr, sodass der kognitive Aufwand irgendwann nicht mehr ausreicht, um einen Wiederanstieg des Gewichts zu verhindern. Während behaviorale Therapieansätze auf eine Stärkung der kognitiven Kontrolle abzielen, ist es das Ziel sowohl einer pharmakologischen als auch chirurgischen Adipositastherapie, den pathologisch gesteigerten «bottom-up»-Antrieb dauerhaft zu reduzieren (Abb. 2).
Pharmakotherapie und bariatrische Chirurgie wirken entlastend
Modelhaft kann man als pathophysiologisches Grundkonzept bei der Adipositas auch von einem nach oben verschobenen Set-Point des Körpergewichts ausgehen. Wie Abbildung 3 illustriert, gelingt es den betroffenen Personen zwar oft durch willentliche Anstrengungen, ihr Körpergewicht und damit ihre Körperfettmasse vorübergehend zu reduzieren, jedoch zieht der nach oben verschobene Set-Point wie eine aufgespreizte Spiralfeder das Körpergewicht wieder nach oben zurück.
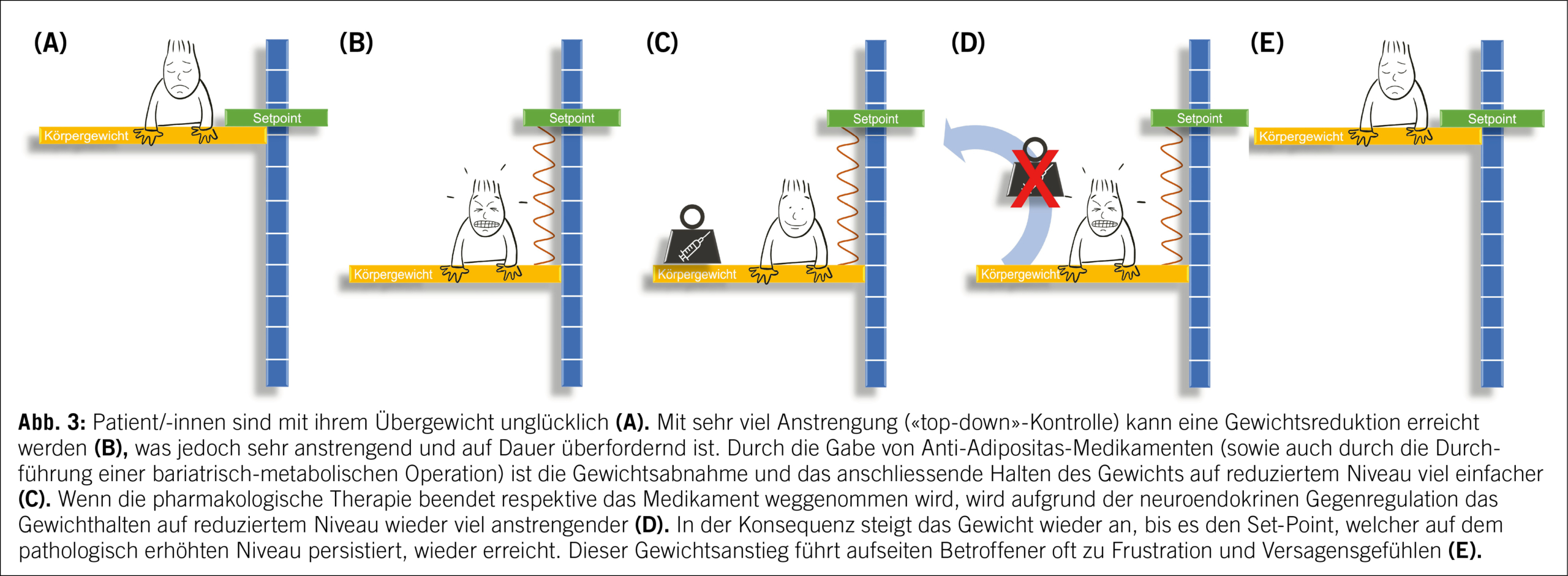
Pharmakologische Interventionen sowie auch bariatrisch-metabolische Operationen können dabei helfen, das Gewicht auf reduziertem Niveau zu halten und dadurch betroffene Personen kognitiv zu entlasten. In der Praxis berichten viele der medikamentös und chirurgisch behandelten Patient/-innen, sich durch die Therapie von dem Zwang, permanent ihr Essverhalten unter Kontrolle halten zu müssen, befreit zu fühlen. Die Patient/-innen erlangen also durch die Therapie die Kontrolle über etwas zurück, über das sie zwischenzeitlich die Kontrolle verloren haben: das Essverhalten sowie das Hunger- und Appetitempfinden. Vor dem Hintergrund der bereits zuvor erwähnten Tatsache, dass das verstärkte Hungergefühl als Leitsymptom und nicht als Ursache der Erkrankung angesehen werden muss, kann man also konstatieren, dass es sich bei den pharmakologischen und chirurgischen Behandlungen um kausale Therapieansätze handelt. Dies geht meist mit einer erheblichen Steigerung der Lebensqualität einher. Wird dann jedoch die Pharmakotherapie beispielsweise aufgrund einer fehlenden Finanzierung beendet, so wird das Gewicht wieder «nach oben» gezogen, was nicht selten mit Versagensgefühlen seitens betroffener Personen und grosser Frustration einhergeht. Da bislang eine langfristige Finanzierung von medikamentösen Therapien der Adipositas durch die obligatorische Krankenversicherung aufgrund des, oben als Mythos bezeichneten, Fehlkonzepts der Adipositaserkrankung nicht gegeben ist, sollte diese langfristige Perspektive bei der Therapieplanung immer berücksichtigt werden. Die bariatrische Chirurgie bietet hier klar den Vorteil, dass durch eine einmalige Intervention ein langfristiger Effekt auf die chronische Erkrankung ausgeübt wird und somit nicht von einer dauerhaften Finanzierung abhängig ist.
Aktuelle Pharmakotherapie der Adipositas
Über die letzten Jahrzehnte hinweg erschien eine ganze Reihe verschiedener Medikamente zur Behandlung der Adipositas auf dem Markt (2, 3). Da sich aber bei einer Vielzahl dieser Medikamente bei breiter Anwendung eine hohe Rate an unerwünschten Nebenwirkungen zeigte, die das Risiko-Nutzen-Verhältnis infrage stellten, verschwanden viele dieser Medikamente ebenso schnell, wie sie gekommen waren. Daher ist es umso erfreulicher, dass nun zunehmend Medikamente entwickelt wurden und werden, welche nicht nur deutlich effektiver sind als alle Medikamente, die uns bisher zur Behandlung der Adipositas zur Verfügung standen, sondern darüber hinaus auch ein besseres Nutzen-Risiko-Verhältnis aufzuweisen scheinen. Es handelt sich dabei im Wesentlichen um Substanzen, die als Agonisten am GLP-1-Rezeptor eine agonistische Wirkung entfalten. Diese Substanzgruppe kennen wir mittlerweile bereits seit bald zwei Jahrzehnten in der Therapie des Typ-2-Diabetes-mellitus (T2DM).
Für die Adipositastherapie sind in der Schweiz aktuell zwei GLP-1-Rezeptoragonisten (RA) zugelassen. Unter dem Namen Saxenda® ist Liraglutid bereits seit einigen Jahren im Einsatz. Liraglutid wird seit Beginn 2024 zunehmend durch Semaglutid (Handelsname: Wegovy®) ersetzt, welches einerseits wirksamer ist, anderseits im Gegensatz zu Liraglutid nicht täglich, sondern nur einmal wöchentlich s.c. appliziert wird. Unter Erfüllung der in der Spezialitätenliste des Bundesamtes für Gesundheit (BAG) definierten Limitatio werden beide Medikamente von den Krankenkassen aktuell über maximal 3 Jahre finanziert. Vor dem Hintergrund der oben dargestellten Chronizität der Adipositaserkrankung macht die zeitliche Limitation der Kostenübernahme medizinisch betrachtet keinen Sinn.
Eine dritte, in vielen Ländern bereits für die Adipositas-therapie zugelassene Substanz ist Tirzepatid (Handelsname: Mounjaro®), welche sowohl agonistisch am GLP-1-Rezeptor als auch am Rezeptor des glukoseabhängigen insulinotropen Polypeptids (GIP) wirkt.
Haupteffekt der genannten Medikamente ist eine Verminderung des Appetits sowie eine frühzeitige Sättigung nach Nahrungsaufnahme (4–7). Experimentelle Untersuchungen konnten zeigen, dass durch die Gabe von GLP-1- RA die Verarbeitung von visuellen Reizen im Gehirn, die unter normalen Bedingungen zur Nahrungsaufnahme anregen, deutlich unterdrückt wird (8). Dies erleichtert es betroffenen Personen, Kontrolle über ihr Essverhalten auszuüben, um eine Restriktion der Energiezufuhr zu erreichen und dadurch ihr Gewicht und ihre Körperfettmasse zu reduzieren.
Hinsichtlich ihres gewichtsreduzierenden Effektes zeigen die genannten Medikamente eine klare Dosis-Wirkung-Beziehung (9, 10). Gleiches gilt in der Regel auch für das Auftreten typischer Nebenwirkungen, insbesondere gastrointestinale Beschwerden wie Übelkeit, Erbrechen, Diarrhö oder auch Obstipation. Da solche Beschwerden insbesondere zu Beginn der Behandlung auftreten, werden die genannten Medikamente durch eine schrittweise Dosissteigerung eingeschlichen. Man muss jedoch damit rechnen, dass etwa 5 % der behandelten Patient/-innen die Medikation aufgrund von Nebenwirkungen nicht vertragen und die Therapie daher abgebrochen werden muss. Als ernsthafte Komplikationen sind zudem das gehäufte Auftreten von Gallenblasensteinen und Pankreatitiden zu erwähnen.
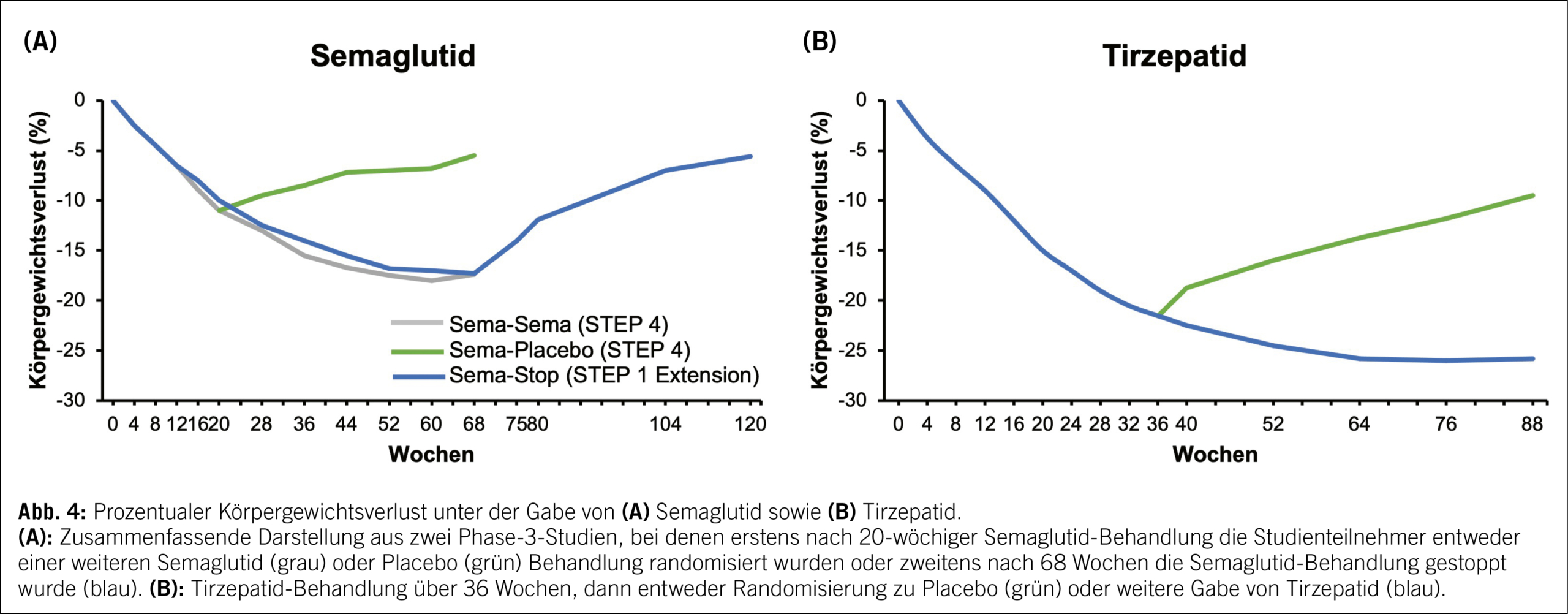
Gemäss den Zulassungsstudien der genannten Medikamente erreicht man unter Liraglutid eine durchschnittliche Gewichtsreduktion von etwa 8 % im Vergleich zum Ausgangsgewicht, unter Semaglutid von etwa 15 % sowie unter Tirzepatid von etwa 21 % (11–13). Ist der gewichtsreduzierende Effekt ausgeschöpft, so dient die fortgeführte Medikation dem Ziel, das Gewicht und damit auch die Fettmasse auf dem reduzierten Niveau zu halten. Stoppt man die Medikation, so kommt es zeitnah zu einem graduellen Wiederanstieg des Körpergewichts, wie in einigen Studien eindrücklich gezeigt werden konnte (Abb. 4) (14–16).
Die Pharmakotherapie der Adipositas unterscheidet sich somit prinzipiell nicht von anderen medikamentösen Behandlungen, wie beispielsweise der pharmakologischen antihypertensiven oder Cholesterin senkenden Therapie, bei der man ebenfalls von einem Wiederanstieg der adressierten Variablen ausgehen kann, sobald die Therapie beendet wird.
Dass eine pharmakologische Adipositastherapie nicht nur das Körpergewicht und die Körperfettmasse reduziert, sondern darüber hinaus auch das Risiko von Komplikationen der Adipositas senkt, wurde erstmalig in der SELECT-Studie gezeigt (17). In dieser Studie wurden 17 604 Personen mit einen BMI von mindestens 27 kg/m2 und vorbestehender kardiovaskulärer Erkrankung (stattgehabter Herzinfarkt, stattgehabter Schlaganfall oder periphere arterielle Verschlusskrankheit) eingeschlossen und entweder mit Placebo oder 2.4 mg Semaglutid 1 x pro Woche s.c. behandelt. Als Ergebnis zeigte sich, dass nach einer mittleren Behandlungsdauer von etwa 34 Monaten das Auftreten des zusammengesetzten primären Endpunkts (kardiovaskulärer Tod, nicht tödlicher Myokardinfarkt, nicht tödlicher Schlaganfall) durch die Behandlung mit Semaglutid gegenüber der Placebobehandlung um 20 % reduziert wurde (Placebo vs. Semaglutid: 8 % vs. 6.5 %, hazard ratio, 0.80; 95 % Konfidenzintervall, 0.72–0.90; P< 0.001). Die absolute Risikoreduktion betrug somit 1.5 %; die number-needed-to-treat über 34 Monate betrug 67.
Bariatrisch-metabolische Chirurgie
Die bariatrisch-metabolische Chirurgie hat sich in den letzten 30 Jahren weltweit als Standardtherapie der ausgeprägten Adipositas etabliert. Bei gegebener Indikation ist sie in der Schweiz als Pflichtleistung in der Krankenpflege-Leistungsverordnung (KVL) verankert. Die wesentlichen Indikationskriterien zur Durchführung einer bariatrisch-metabolischen Operation sind in Tabelle 1 zusammengefasst.

Obgleich es mittlerweile eine Vielzahl an unterschiedlichen Operationsverfahren gibt, gelten heute in der Schweiz der Roux-en-Y-Magenbypass (Roux-en-Y gastric bypass, RYGB) sowie die Schlauchmagenresektion (Sleeve-Gastrektomie) als Standardverfahren, welche auch weltweit am meisten angewendet werden. Wichtig ist dabei zu verstehen, dass beide Operationen zu einer veränderten Ausschüttung von gastrointestinalen Hormonen, wie unter anderen GLP-1, führen (18) und dadurch einen starken Hunger und Appetit vermindernden Einfluss auf die zentralnervösen Regulationszentren ausüben (19). So konnten beispielsweise Neuroimaging-Studien zeigen, dass sich die zentralnervöse Verarbeitung von stimulierenden Nahrungsreizen nach bariatrisch-metabolischen Operationen deutlich verändert (20, 21). Die Effekte der Operationen basierten somit weniger auf den durch sie etablierten anatomisch/mechanischen Veränderungen, sondern auf ihrem Einfluss auf die zentralnervösen Regulationszentren, was somit einen kausalen Therapieansatz darstellt – anlog zur medikamentösen Therapie, wie bereits oben ausgeführt.
Das Grundprinzip des RYGB basiert auf der Trennung von Nahrungsbrei und Verdauungssäften im oberen Gastrointestinaltrakt. Dazu wird eine kleine Magentasche direkt unterhalb des ösophagogastralen Übergangs vom restlichen Magen abgetrennt (Abb. 5).
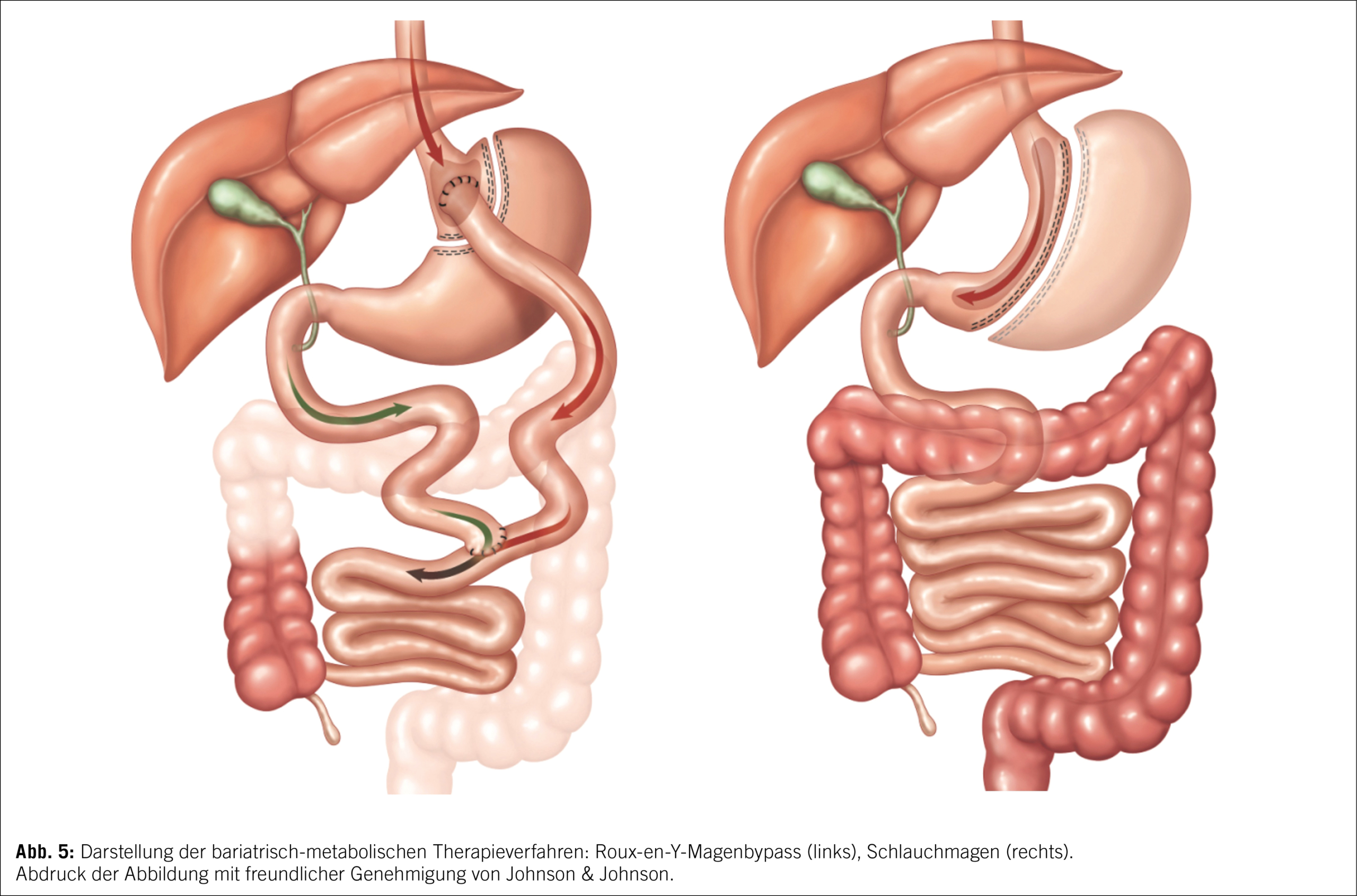
Der ausgeschaltete Restmagen verbleibt in situ. Das Jejunum wird anschliessend etwa 50–70 cm aboral der Flexura duodenojejunalis (Treitz-Flexur) durchtrennt und als sog. alimentärer Schenkel mit der Magentasche anastomosiert (sog. Gastrojejunostomie). Anschliessend wird der proximale Abschnitt des Jejunums, in dem die Verdauungssäfte ohne Kontakt zum Nahrungsbrei transportiert werden (sog. biliopankreatischer Schenkel), ca. 150 cm aboral der Gastrojejunostomie Seit-zu-Seit mit dem alimentären Schenkel des Jejunums verbunden. Erwähnenswert ist, dass diese Art der Operation durch einen erneuten chirurgischen Eingriff wieder umgekehrt werden kann und somit reversibel ist, was jedoch nur in sehr seltenen Fällen nötig ist.
Bei der Schlauchmagenresektion (Sleeve-Gastrektomie) werden ca. 90 % des Magenvolumens grosskurvaturseitig entfernt, sodass nur noch ein schlauchförmiger Restmagen mit ca. 80–100 ml Fassungsvolumen verbleibt (Abbildung 5 rechts). Die anatomische Nahrungspassage und die Verdauungssekrete werden durch diese Operation nicht verändert. Dieser Eingriff ist im Vergleich zum laparoskopischen RYGB technisch einfacher, was wesentlich zu seiner dominanten Verbreitung weltweit beigetragen hat.
Beide Operationsverfahren, Schlauchmagen und RYGB, zeigen bezüglich dauerhafter Gewichtsreduktion (langfristig etwa 25–30 %) sowie auch Verbesserung vieler Adipositas-assoziierter Komorbiditäten vergleichbare Ergebnisse (22, 23). Auch hinsichtlich Komplikations- und Sterblichkeitsrate bestehen keine gravierenden Unterschiede zwischen den beiden Verfahren (24) . Bei präoperativ vorhandener gastroösophagealer Refluxerkrankung (GERD) bietet die RYGB-Operation jedoch deutliche Vorteile (25), da sie das Problem meist behebt, während der Schlauchmagen sogar das Neuauftreten von GERD fördert und mit einem erhöhten Risiko des Entstehens von Barrett-Metaplasien einherzugehen scheint (26). Auch hinsichtlich der Behandlung des Typ-2-Diabetes-mellitus scheint der RYGB etwas effektiver zu sein (27). Im Gegensatz zum RYGB führt die Schlauchmagenresektion nicht zu einer Umgehung des Duodenums sowie des proximalen Jejunums, sodass die Mikronährstoffaufnahme weniger beeinträchtigt wird. Entsprechend ist nach einer Schlauchmagenresektion eine weniger systematische Supplementation (insbesondere von Calcium) als nach einem RYGB notwendig. Zudem treten postprandiale Hypoglykämien im Sinne eines Spätdumping-Syndroms weitaus seltener nach einer Schlauchmagenresektion als nach der RYGB-Operation auf.
Generell kann die bariatrisch-metabolische Chirurgie heute als sicher angesehen werden. So liegt die Rate von schwerwiegenden Komplikationen (z.B. revisionspflichtige Nachblutungen, Klammernahtleckagen oder Anastomoseninsuffizienzen) bei etwa 1–3 %. Aufgrund eines postoperativen Problems (Wundinfekt, Thrombose, Lungenembolie, Darmpassageproblematik etc.) werden etwa 3–4 % der operierten Patient/-innen innerhalb von 30 Tagen erneut hospitalisiert, die 30-Tage-Mortalität beträgt 0.05–0.2 % (28).
Wie bei allen chronischen Erkrankungen ist auch bei Menschen mit Adipositas, welche sich einer bariatrisch-metabolischen Operation unterzogen haben, eine dauerhafte medizinische Betreuung notwendig. Hierbei geht es beispielsweise darum, der Entstehung von Mikronährstoffmängeln durch eine systematische Supplementation sowie entsprechende Laborkontrollen entgegenzuwirken. Andere Probleme, welche im postoperativen Verlauf auftreten können, sind beispielsweise die Entstehung von inneren Hernien, das Auftreten eines erhöhten Alkoholkonsums sowie evtl. eine erhöhte Suizidalität und damit verbunden psychischen Problemen (29).
Trotz des potenziellen Auftretens schwerwiegender Komplikationen überwiegen in der breiten Anwendung die positiven Effekte der bariatrisch-metabolischen Chirurgie ihre potenziellen Risiken deutlich. So konnte in vielen Studien klar gezeigt werden, dass die Funktionstüchtigkeit verschiedener Organsysteme wie Herz, Niere, Leber, Lunge sowie Gehirn nach einer bariatrisch-metabolischen Operation länger erhalten bleibt oder sich sogar verbessert (30–35). Zudem konnte auch eine Reduktion der Inzidenz von Adipositas-assoziierten Krebserkrankungen um 32 % sowie eine Reduktion der Krebs-assoziierten Mortalität um 48 % nach bariatrisch-metabolischen Operationen nachgewiesen werden (36). Eindrücklich sind auch die Ergebnisse einer Registerstudie (37), welche eine Verlängerung der Lebenserwartung von Menschen mit Adipositas durch bariatrisch-metabolische Operationen um durchschnittlich 6.1 Jahre fand. Bei Personen, welche zusätzlich präoperativ einen T2DM aufwiesen, betrug die errechnete Verlängerung der Lebenserwartung sogar 9.3 Jahre.
Stoffwechselzentrum St. Gallen, friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Centre du métabolisme de Saint-Gall
friendlyDocs AG
Lerchentalstrasse 21
9016 St. Gallen
stoffwechselzentrum@friendlydocs.ch
Universitätsspital Zürich, Klinik für Viszeralchirurgie,
& Spital Männedorf AG, Klinik Chirurgie
m.bueter@spitalmaennedorf.ch
Prof. Dr. med. Bernd Schultes gibt an, Vortragstätigkeiten für die Firmen Novo Nordisk, Elli Lilly, Johnson & Johnson, Böhringer-Ingelheim durchzuführen sowie an advisory boards dieser Firmen teilzunehmen. Diese Firmen produzieren und/oder erforschen u.a. Arzneimittel und Medizinprodukte zur Behandlung von Adipositas. Zudem war er als Investigator an klinischen Studien der Firma Novo Nordisk beteiligt.
Dr. rer. hum. biol. Barbara Ernst gibt an, als Studienkoordinatorin an klinischen Studien der Firma Novo Nordisk beteiligt gewesen zu sein.
Prof. Dr. med. Marco Bueter gibt an, Vortragstätigkeiten für die Firmen Johnson & Johnson und Medtronic durchzuführen.
Literatur
1. Schultes B, Ernst B, Hallschmid M, Bueter M, Meyhöfer SM. The “Behavioral Balance Model”: A new perspective on the aetiology and therapy of obesity. Diabetes Obes Metab. 2023 Dec;25(12):3444–52.
2. Schultes B. Pharmacological Interventions against Obesity: Current Status and Future Directions. Visc Med. 2016 Oct;32(5):347–51.
3. Schultes B. Medikamentöse Therapie der Adipositas – Aerzteverlag medinfo AG [Internet]. [cited 2023 Feb 6]. Available from: https://www.medinfo-verlag.ch/medikamentoese-therapie-der-adipositas/
4. Blundell J, Finlayson G, Axelsen M, Flint A, Gibbons C, Kvist T, et al. Effects of once-weekly semaglutide on appetite, energy intake, control of eating, food preference and body weight in subjects with obesity. Diabetes Obes Metab. 2017 Sep;19(9):1242–51.
5. Tronieri JS, Wadden TA, Walsh O, Berkowitz RI, Alamuddin N, Gruber K, et al. Effects of liraglutide on appetite, food preoccupation, and food liking: results of a randomized controlled trial. Int J Obes (Lond). 2020 Feb;44(2):353–61.
6. Kadouh H, Chedid V, Halawi H, Burton DD, Clark MM, Khemani D, et al. GLP-1 Analog Modulates Appetite, Taste Preference, Gut Hormones, and Regional Body Fat Stores in Adults with Obesity. J Clin Endocrinol Metab. 2020 May 1;105(5):1552–63.
7. Friedrichsen M, Breitschaft A, Tadayon S, Wizert A, Skovgaard D. The effect of semaglutide 2.4 mg once weekly on energy intake, appetite, control of eating, and gastric emptying in adults with obesity. Diabetes Obes Metab. 2021 Mar;23(3):754–62.
8. Om F, M S, Ma T, F D, B T, A SE, et al. GLP-1 receptors exist in the parietal cortex, hypothalamus and medulla of human brains and the GLP-1 analogue liraglutide alters brain activity related to highly desirable food cues in individuals with diabetes: a crossover, randomised, placebo-controlled trial. Diabetologia [Internet]. 2016 May [cited 2023 Feb 6];59(5). Available from: https://pubmed.ncbi.nlm.nih.gov/26831302/
9. Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean MEJ, et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond). 2012 Jun;36(6):843–54.
10. O’Neil PM, Birkenfeld AL, McGowan B, Mosenzon O, Pedersen SD, Wharton S, et al. Efficacy and safety of semaglutide compared with liraglutide and placebo for weight loss in patients with obesity: a randomised, double-blind, placebo and active controlled, dose-ranging, phase 2 trial. Lancet. 2018 Aug 25;392(10148):637–49.
11. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2;373(1):11–22.
12. Wilding JPH, Batterham RL, Calanna S, Davies M, Van Gaal LF, Lingvay I, et al. Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 2021 Mar 18;384(11):989–1002.
13. Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B, et al. Tirzepatide Once Weekly for the Treatment of Obesity. New England Journal of Medicine. 2022 Jul 21;387(3):205–16.
14. Rubino D, Abrahamsson N, Davies M, Hesse D, Greenway FL, Jensen C, et al. Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA. 2021 Apr 13;325(14):1414–25.
15. Wilding JPH, Batterham RL, Davies M, Van Gaal LF, Kandler K, Konakli K, et al. Weight regain and cardiometabolic effects after withdrawal of semaglutide: The STEP 1 trial extension. Diabetes Obes Metab. 2022 Aug;24(8):1553–64.
16. Aronne LJ, Sattar N, Horn DB, Bays HE, Wharton S, Lin WY, et al. Continued Treatment With Tirzepatide for Maintenance of Weight Reduction in Adults With Obesity: The SURMOUNT-4 Randomized Clinical Trial. JAMA. 2024 Jan 2;331(1):38–48.
17. Lincoff AM, Brown-Frandsen K, Colhoun HM, Deanfield J, Emerson SS, Esbjerg S, et al. Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Dec 14;389(24):2221–32.
18. Peterli R, Steinert RE, Woelnerhanssen B, Peters T, Christoffel-Courtin C, Gass M, et al. Metabolic and Hormonal Changes After Laparoscopic Roux-en-Y Gastric Bypass and Sleeve Gastrectomy: a Randomized, Prospective Trial. Obes Surg. 2012;22(5):740–8.
19. Al-Najim W, Docherty NG, Le Roux CW. Food Intake and Eating Behavior After Bariatric Surgery. Physiological Reviews. 2018 Jul 1;98(3):1113–41.
20. Zakeri R, Batterham RL. Potential mechanisms underlying the effect of bariatric surgery on eating behaviour. Curr Opin Endocrinol Diabetes Obes. 2018 Feb;25(1):3–11.
21. Frank S, Wilms B, Veit R, Ernst B, Thurnheer M, Kullmann S, et al. Altered brain activity in severely obese women may recover after Roux-en Y gastric bypass surgery. Int J Obes (Lond). 2014 Mar;38(3):341–8.
22. Salminen P, Helmiö M, Ovaska J, Juuti A, Leivonen M, Peromaa-Haavisto P, et al. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss at 5 Years Among Patients With Morbid Obesity: The SLEEVEPASS Randomized Clinical Trial. JAMA. 2018 Jan 16;319(3):241–54.
23. Peterli R, Wölnerhanssen BK, Peters T, Vetter D, Kröll D, Borbély Y, et al. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss in Patients With Morbid Obesity: The SM-BOSS Randomized Clinical Trial. JAMA. 2018 Jan 16;319(3):255–65.
24. Howard R, Chao GF, Yang J, Thumma J, Chhabra K, Arterburn DE, et al. Comparative Safety of Sleeve Gastrectomy and Gastric Bypass Up to 5 Years After Surgery in Patients With Severe Obesity. JAMA Surg. 2021 Dec 1;156(12):1160–9.
25. Felsenreich DM, Kefurt R, Schermann M, Beckerhinn P, Kristo I, Krebs M, et al. Reflux, Sleeve Dilation, and Barrett’s Esophagus after Laparoscopic Sleeve Gastrectomy: Long-Term Follow-Up. Obes Surg. 2017 Dec;27(12):3092–101.
26. Genco A, Soricelli E, Casella G, Maselli R, Castagneto-Gissey L, Di Lorenzo N, et al. Gastroesophageal reflux disease and Barrett’s esophagus after laparoscopic sleeve gastrectomy: a possible, underestimated long-term complication. Surg Obes Relat Dis. 2017 Apr;13(4):568–74.
27. Schauer PR, Bhatt DL, Kirwan JP, Wolski K, Aminian A, Brethauer SA, et al. Bariatric Surgery versus Intensive Medical Therapy for Diabetes – 5-Year Outcomes. N Engl J Med. 2017 Feb 16;376(7):641–51.
28. Gero D, Raptis DA, Vleeschouwers W, van Veldhuisen SL, Martin AS, Xiao Y, et al. Defining Global Benchmarks in Bariatric Surgery: A Retrospective Multicenter Analysis of Minimally Invasive Roux-en-Y Gastric Bypass and Sleeve Gastrectomy. Ann Surg. 2019 Nov;270(5):859–67.
29. Van den Eynde A, Mertens A, Vangoitsenhoven R, Meulemans A, Matthys C, Deleus E, et al. Psychosocial Consequences of Bariatric Surgery: Two Sides of a Coin: a Scoping Review. Obes Surg. 2021 Dec;31(12):5409–17.
30. Docherty NG, le Roux CW. Bariatric surgery for the treatment of chronic kidney disease in obesity and type 2 diabetes mellitus. Nat Rev Nephrol. 2020 Dec;16(12):709–20.
31. Sheka AC, Adeyi O, Thompson J, Hameed B, Crawford PA, Ikramuddin S. Nonalcoholic Steatohepatitis: A Review. JAMA. 2020 Mar 24;323(12):1175–83.
32. Powell-Wiley TM, Poirier P, Burke LE, Després JP, Gordon-Larsen P, Lavie CJ, et al. Obesity and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation. 2021 May 25;143(21):e984–1010.
33. Qin H, Wang Y, Chen X, Steenbergen N, Penzel T, Zhang X, et al. The efficacy of bariatric surgery on pulmonary function and sleep architecture of patients with obstructive sleep apnea and co-morbid obesity: a systematic review and meta-analysis. Surg Obes Relat Dis. 2023 Aug 1;S1550-7289(23)00602-0.
34. Xie L, Chandrasekhar A, DeSantis SM, Almandoz JP, de la Cruz-Muñoz N, Messiah SE. Discontinuation and reduction of asthma medications after metabolic and bariatric surgery: A systematic review and meta-analysis. Obes Rev. 2023 Feb;24(2):e13527.
35. Handley JD, Williams DM, Caplin S, Stephens JW, Barry J. Changes in Cognitive Function Following Bariatric Surgery: a Systematic Review. Obes Surg. 2016 Oct;26(10):2530–7.
36. Aminian A, Wilson R, Al-Kurd A, Tu C, Milinovich A, Kroh M, et al. Association of Bariatric Surgery With Cancer Risk and Mortality in Adults With Obesity. JAMA. 2022 Jun 28;327(24):2423–33.
37. Syn NL, Cummings DE, Wang LZ, Lin DJ, Zhao JJ, Loh M, et al. Association of metabolic-bariatric surgery with long-term survival in adults with and without diabetes: a one-stage meta-analysis of matched cohort and prospective controlled studies with 174 772 participants. Lancet. 2021 May 15;397(10287):1830–41.
Therapeutische Umschau
- Vol. 81
- Ausgabe 3
- Juni 2024