- Moderne Endoskopie bei chronisch entzündlichen Darmerkrankungen
Endoskopische Untersuchungen spielen in der Diagnosestellung, Verlaufsbeurteilung und Therapie von chronisch entzündlichen Darmerkrankungen (inflammatory bowel diseases, IBD) eine entscheidende Rolle. Dazu gehören nicht nur die Ösophagogastroduodenoskopie, Sigmoidoskopie und Ileo-Koloskopie, sondern auch die Beurteilung des Dünndarms. Die Diagnostik des Dünndarms erfolgt vor allem durch nicht-invasive Techniken (intestinale Sonographie, Magnetresonanz-Enterographie (MRE)). Bleibt die Diagnose auch nach der Durchführung dieser Verfahren unklar, ist ein histologischer Nachweis notwendig oder wird eine endoskopische Intervention notwendig, kommen die Kapselendoskopie sowie die Ballon-assistierten Enteroskopieverfahren zum Einsatz. Ausserdem stehen der endoskopische Ultraschall zur Beurteilung eines perianal fistulierenden Morbus Crohn sowie die ERCP (endoskopische retrograde Cholangiopankreatikographie) bei IBD- assoziierter primär sklerosierenden Cholangitis (PSC) mit Komplikationen zur Verfügung. Dank der besseren Auflösung der Endoskope sowie der Chromoendoskopie werden dysplastische Läsionen besser erkannt und können häufig auch endoskopisch reseziert werden. Kurzstreckige Strikturen/ Stenosen können mittels Ballon-Dilatationen behandelt werden.
Einleitung
Zu den chronisch entzündlichen Darmerkrankungen (inflammatory bowel diseases, IBD) gehören der Morbus Crohn und die Colitis ulcerosa. Handelt es sich um eine IBD, die nicht sicher einem Morbus Crohn oder einer Colitis ulcerosa zugeordnet werden kann, spricht man von einer Colitis indeterminata.
Während die Colitis ulcerosa auf das Kolon beschränkt ist, kann sich der Morbus Crohn im ganzen Gastrointestinal-Trakt manifestieren. Beide Erkrankungen können zu extraintestinalen Symptomen führen, die vor allem in den Gelenken (z.B. Arthritis, Sakroileitis), den Augen (z.B. Uveitis, Skleritis) und der Haut (z.B. Erythema nodosum, Pyoderma gangränosum, Sweet-Syndrom) auftreten.
Bei der Colitis ulcerosa ist als endoskopische Abklärung somit meist nur eine Ileo-Koloskopie indiziert, während beim Morbus Crohn auch der obere und mittlere Gastrointestinal-Trakt beurteilt werden sollte.
Neben der Ileo-Koloskopie, Rektosigmoidoskopie und Ösophagogastroduodenoskopie stehen mittlerweile auch endoskopische Abklärungen beziehungsweise Therapien des Dünndarms mittels Kapselendoskopien und Ballon-Enteroskopien zur Verfügung. Zudem werden Färbetechniken zur besseren Detektion dysplastischer Läsionen angewendet (Chromoendoskopie).
Den Stellenwert dieser Untersuchungen werden wir in dieser Übersicht erläutern.
Endoskopie zur Diagnosestellung einer chronisch entzündlichen Darmerkrankung
Ileo-Koloskopie/ Sigmoidoskopie
Präsentiert sich ein Patient mit den typischen Symptomen einer IBD (blutige Durchfälle, Bauchschmerzen, Passagebehinderung, Fisteln) ist mit Ausnahme einer akuten schweren Colitis ulcerosa oder eines toxischen Megacolons, wo aufgrund der Gefahr einer iatrogenen Perforation lediglich eine Rektosigmoidoskopie durchgeführt werden sollte, eine komplette Ileo-Koloskopie der primäre Abklärungsschritt (1). Sie erlaubt die direkte Beurteilung des Schweregrades der Entzündung und deren Verteilungsmuster sowie die Entnahme von Biopsien. Ausserdem gibt sie uns Rückschlüsse, ob es sich um eine Colitis ulcerosa oder einen Morbus Crohn handelt und hilft uns, relevante Differentialdiagnosen (z. B. ischämische Colitis, medikamentös-induzierte Colitis, infektiöse Colitis, SCAD (segmental colitis associated with diverticulosis)) zu erkennen. Dabei gilt es zu erwähnen, dass bei Vorliegen einer akuten Symptomatik eine infektiöse Colitis mittels Stuhlkulturen (allgemeine Bakteriologie, Clostridium difficile-Toxin-Nachweis) gesucht werden soll, womit sich bei jungen Patienten mit positivem Keimnachweis eine Koloskopie erübrigt (1).
Bei der Colitis ulcerosa, die durch eine rein mukosale Entzündung charakterisiert ist, beginnt die Entzündung meist im Rektum und dehnt sich kontinuierlich nach proximal aus. Besteht bereits eine topische Therapie, kann das Rektum ausgespart sein. Dies gilt ebenfalls für eine Colitis ulcerosa, die mit einer primär sklerosierenden Cholangitis (PSC) vergesellschaftet ist, bei der typischerweise eine rechtsbetonte Colitis vorherrschend ist mit Aussparung des Rektums (2). Unter Therapie kann die Entzündung zudem diskontinuierlich (patchy) imponieren. Ausserdem haben ca. 5% der Patienten mit einer distalen Colitis ulcerosa (und somit unauffälligem rechten Kolon) eine zusätzliche isolierte Entzündung um die Appendixgrube (cecal patch), die weder eine Korrelation mit der Krankheitsaktivität noch mit der Prognose hat und nicht speziell therapiert werden muss (3).
Die klassischen endoskopischen Zeichen einer Colitis ulcerosa sind Ödem, Erythem, Verlust der Gefässzeichnung, Kontaktvulnerabilität bis hin zu spontanen Blutungen, eher oberflächliche Erosionen und Ulzerationen sowie eine Demarkationslinie (mehr oder weniger abrupt), die die entzündete von der normalen Schleimhaut trennt. Im Verlauf können auch Pseudopolypen und Narben auftreten. Eine Striktur oder Stenose im Colon ist bei einer Colitis ulcerosa möglich aber eher selten, sodass in dieser Situation auch an das Vorhandensein eines Morbus Crohn gedacht und insbesondere auch ein Malignom ausgeschlossen werden muss (2).
Klassische Zeichen des Morbus Crohn, welcher durch eine transmurale Entzündung charakterisiert ist, sind ein Befall des terminalen Ileums (CAVE: eine Pancolitis ulcerosa kann in bis zu 25 % eine backwash Ileitis verursachen, diese ist aber meist nur mild ausgeprägt), eine segmentale Entzündung (skip lesions), aphthöse, tiefe oder serpingiöse Ulzera und ein Pflastersteinrelief (cobble stone relief). Das Rektum ist oft ausgespart, wobei bei perianalem Befall oder einer Crohn-Colitis dieses durchaus auch involviert sein kann. Manchmal gelingt auch die Darstellung einer internen Fistelöffnung, wobei der perianale Befall oft bereits bei der Inspektion der Perianalregion sichtbar ist.
Die klare Zuordnung zu einem dieser zwei Krankheitsbilder gelingt in ca. 90 % der Fälle. Ist eine eindeutige Zuordnung zu einem Morbus Crohn oder Colitis ulcerosa nicht möglich, spricht man von einer Colitis indeterminata (2).
Bei der Initialbeurteilung sollten Biopsien entnommen werden. Die Entnahme von mindestens zwei Biopsien von entzündeten und nicht entzündeten Regionen segmentweise (inklusive Rektum/ Ileum) werden empfohlen (1).
Wie bereits erwähnt sollte bei einer akuten schweren Colitis ulcerosa respektive eines toxischen Megakolons auf eine komplette Ileo-Koloskopie verzichtet werden und lediglich eine Rektosigmoidoskopie durchgeführt werden. Dies erlaubt ausreichend die Beurteilung der Aktivität sowie die Biopsie-Entnahme zur Suche einer Cytomegalie-Infektion (CMV-Colitis) (1).
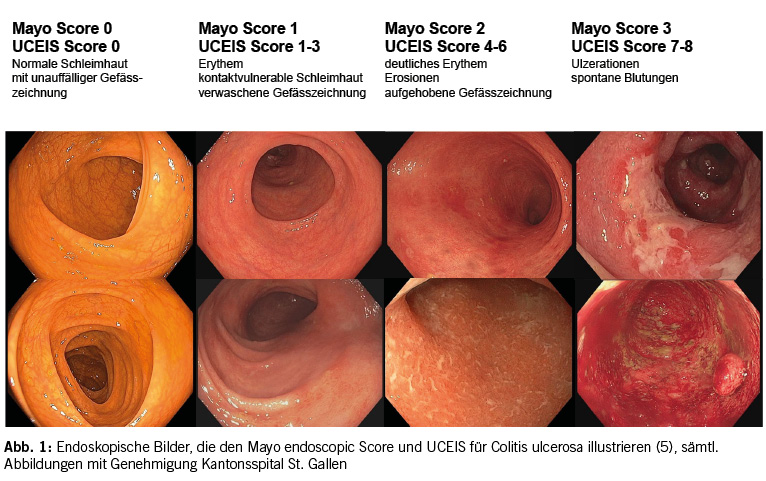
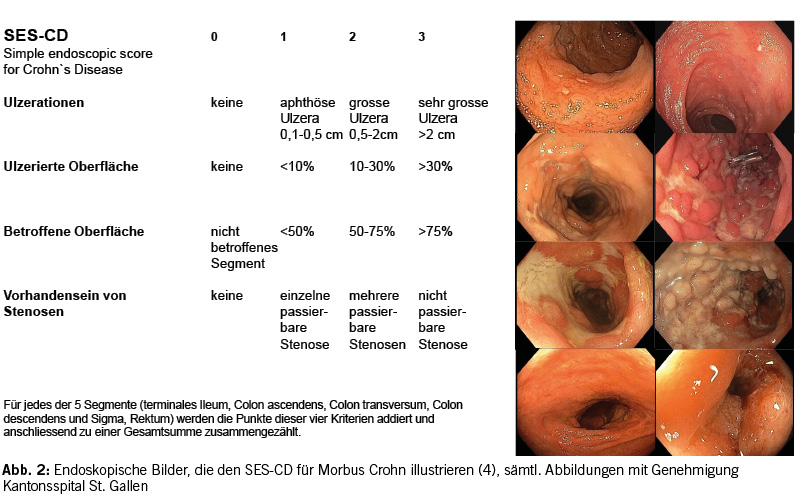
Um den endoskopischen Befund zu objektivieren und die Kommunikation zwischen den beteiligten Betreuungspersonen zu vereinfachen, wurden endoskopische Klassifikationen (Scores) entwickelt. Bei der Colitis ulcerosa wird oft der Mayo endoscopic score und der UCEIS (ulcerative colitis endoscopic index for severity), der im Gegensatz zum Mayo endoscopic score validiert ist, verwendet. Beim Morbus Crohn wird heutzutage meist der SES-CD (simple endoscopic score for Crohn`s disease) angewandt (siehe Abb. 1 und 2) (4).
Ösophagogastroduodenoskopie (ÖGD)
Bei fehlenden Symptomen eines Befalles des oberen GI-Traktes ist eine routinemässige ÖGD in der Initialbeurteilung eines Morbus Crohn bei Erwachsenen (im Gegensatz zu Kindern) gemäss ECCO-Guidelines nicht zwingend notwendig (1), wobei dies immer wieder debattiert wird. Eine prospektive Studie zeigte eine Beteiligung des oberen gastrointestinalen Traktes in bis zu 16 %, wobei ein Drittel dieser Patienten asymptomatisch waren (5). Bei Symptomen wie Nausea, Erbrechen oder dyspeptischen Beschwerden sollte immer gastroskopiert werden. Granulome werden dabei im oberen GI-Trakt histologisch eher nachgewiesen als im Kolon, sodass auch empfohlen wird, mindestens zwei Biopsien vom Ösophagus, Magen und Dünndarm zu entnehmen (2). Dies kann mitunter auch für die Unterscheidung eines Morbus Crohn von einer Colitis ulcerosa hilfreich sein.
Auch in differentialdiagnostischer Hinsicht, wie z.B. bei der Diagnostik einer Zöliakie, kann die ÖGD mit Duodenalbiopsien wertvolle Hinweise mit erheblicher therapeutischer Konsequenz liefern (1).
Endoskopische Abklärung des Dünndarms
Wurde die Diagnose eines Morbus Crohn gestellt, sollte der Dünndarm immer abgeklärt werden (1). Sicherlich ist die intestinale Sonographie in den deutschsprachigen Ländern die am häufigsten angewandte Diagnostik des Dünndarms und hat in geübten Händen eine ähnlich gute Aussagekraft bei der Diagnosestellung eines Dünndarm-Crohn wie die Magnetresonanz-Enterographie (MRE). Allerdings ist sie wahrscheinlich in Bezug auf die genaue Ausdehnung der Erkrankung und entero-enterischen Fisteln etwas unterlegen (1).
Mit der intestinalen Sonographie kann neben der Wanddicke auch eine vermehrte Durchblutung als indirektes Zeichen für die entzündliche Aktivität dargestellt werden.
Die Computertomographie-Enterographie (CTE), die eine ähnliche Aussagekraft wie die MRE hat, sollte aufgrund der Strahlenbelastung bei Verfügbarkeit der MRE/ intestinalen Sonographie zurückhaltend eingesetzt werden (1).
Die Videokapselendoskopie (VKE) – bei der eine Kamera-Kapsel geschluckt wird und deren Bilder direkt an einen Datenrekorder gesendet werden, der an einem Gürtel um den Bauch befestigt ist – kann den gesamten Dünndarm nach adäquater Vorbereitung darstellen. Die Sensitivität ist den radiologischen Methoden überlegen, da bereits kleinste mukosale Erosionen detektiert werden können. Vor dem Durchführen einer Videokapselendoskopie muss eine Dünndarm-Stenose ausgeschlossen werden, da sonst das Risiko einer Kapselretention und die Entwicklung eines Ileus droht. Die Spezifität der Kapselendoskopie ist limitiert, da kleine Ulcera bei verschiedenen Krankheiten beobachtet werden (Ischämie, NSAR, andere) und eine Gewebeentnahme nicht möglich ist. Weitere wichtige Indikationen für die Durchführung einer VKE sind die Abklärung einer gastrointestinalen Blutung und eines Eisenmangels bei normaler Gastroskopie und Koloskopie sowie die Suche nach einem isolierten Dünndarm-Crohn bei Erhöhung des Calprotectins. Ein solcher ist wahrscheinlich, wenn mindestens drei Ulzera nachgewiesen werden, sofern der Patient für mindestens 4 Wochen keine NSAR eingenommen hat (1).
Dank der Ballon-assistierten Enteroskopie kann der Dünndarm endoskopisch direkt visualisiert und gegebenenfalls auch biopsiert werden. Auch sind therapeutische Interventionen wie die Dilatation einer Striktur respektive einer Stenose oder eine Blutstillung möglich. Diese Untersuchungen sind invasiv mit relevantem Perforationsrisiko, sodass Ballondilatationen gut indiziert sein müssen (1).
Unter Verwendung all dieser Untersuchungen kann schliesslich die Ausdehnung der chronisch entzündlichen Darmerkrankung beurteilt werden. Die Dokumentation dieser erfolgt meist durch die Montreal-Klassifikation (Morbus Crohn: L1: terminales Ileum; L2: Kolon; L3: Ileo-Kolon; L4: oberer Gastrointestinaltrakt. Colitis ulcerosa: E1: Proktitis; E2: Linksseitenkolitis; E3: Ausdehnung über die linke Flexur hinaus) (7).
Endoskopien zur Verlaufsbeurteilung einer chronisch entzündlichen Darmerkrankung
Eine endoskopische Verlaufsbeurteilung wird bei IBD-Patientinnen und -Patienten aus verschiedenen Gründen durchgeführt. Zum einen kann die Krankheitsaktivität respektive das Ansprechen nach Therapiestart beurteilt werden, zum anderen wird sie als Screening-Untersuchung zur Detektion von Dysplasien oder eines kolorektalen Karzinoms eingesetzt.
Verlaufsbeurteilung der Krankheitsaktivität
Neben dem klinischen Ansprechen/ Remission, der Normalisierung des CRP und des fäkalen Calprotectin-Wertes ist die endoskopisch dokumentierte Mukosaheilung (endoscopic mucosal healing) ein therapeutisches Langzeit-Ziel bei der Behandlung einer IBD (4).
Bei der Colitis Ulcerosa wird die endoskopische Mukosaheilung normalerweise als MES (Mayo endoscopic score, siehe Abb.1) ≤ 1 definiert, wobei eine komplette endoskopische Remission (MES = 0) mit einer besseren Prognose vergesellschaftet ist (4). Bei der Morbus Crohn-Therapie wird ein SES-CD Score von ≤ 2 angestrebt (siehe Abb. 2) (4).
Wann eine endoskopische Kontrolle nach Therapiestart indiziert ist, wird debattiert und muss individuell mit dem Patienten nach dessen Wünschen festgelegt werden. Sie sollte sicherlich immer dann erfolgen, wenn sich eine therapeutische Konsequenz für den Patienten ergibt. Beim Morbus Crohn werden 6 bis 9 Monate nach Start einer Therapie und bei der Colitis ulcerosa werden 3 bis 6 Monate vorgeschlagen (8). Insbesondere bei der Colitis ulcerosa korreliert das fäkale Calprotectin sehr gut mit der entzündlichen Aktivität, sodass die Kombination Klinik/ fäkales Calprotectin/ Darmsonographie in gewissen Situationen durchaus eine nicht-invasive Alternative zur Koloskopie darstellt (1).
Bei einem schweren Schub unter Therapie, persistierender Krankheitsaktivität, neu auftretenden Symptomen und vor einem Therapiewechsel sollte eine endoskopische Abklärung evaluiert werden. Ebenfalls ist bei Patientinnen und Patienten in klinischer Remission vor einer allfälligen Deeskalation oder Beendigung einer Therapie eine Koloskopie sinnvoll, da bei persistierender entzündlicher Aktivität die Wahrscheinlichkeit für ein Wiederauftreten der Erkrankung erhöht ist und somit eine Deeskalation oder ein Therapie-Stopp nicht empfohlen werden sollten (1).
Dysplasiescreening
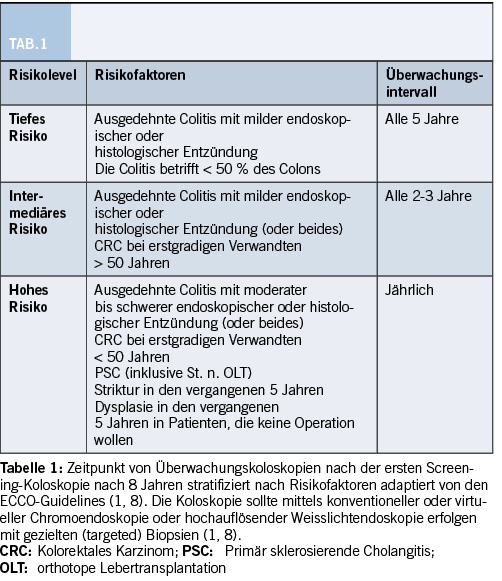
Im Vergleich zur Normalbevölkerung haben Patientinnen und Patienten mit einer chronisch entzündlichen Darmerkrankung ein über 2-fach erhöhtes relatives Risiko, an Darmkrebs zu erkranken. Das Risiko nimmt insbesondere 8-10 Jahre nach Diagnosestellung signifikant zu. Erfreulicherweise bleibt das absolute Risiko hingegen relativ tief (1,1 % bis 5,4 % nach 20 Jahren Erkrankungsdauer) (9). Risikofaktoren sind das männliche Geschlecht, ein junges Alter bei der Diagnosestellung einer Colitis ulcerosa, eine positive Familienanamnese für ein kolorektales Karzinom, eine Striktur im Kolon und eine primär sklerosierende Cholangitis (9). Das Kolonkarzinomrisiko gilt für die Colitis ulcerosa sowie für einen Morbus Crohn mit Befall des Kolons. Aufgrund dessen wird ab acht Jahren nach Symptombeginn ein Dysplasiescreening mittels Koloskopie empfohlen. Idealerweise findet diese im entzündungsfreien Intervall statt, da eine histologische Unterscheidung zwischen Dysplasien und Entzündung schwierig sein kann.
In Hochrisikosituationen wie bei der primär sklerosierenden Cholangitis ist ab Diagnosestellung eine jährliche Koloskopie indiziert (additiv zu einem MRCP und der CA 19-9-Bestimmung) (1).
Bei Patientinnen und Patienten, deren Entzündung immer auf das Rektum beschränkt blieb, ist kein Screening erforderlich (1). Hier ist aber Vorsicht geboten, da sich im Krankheitsverlauf die Colitis ulcerosa nach proximal ausdehnen kann.
Patientinnen und Patienten mit Morbus Crohn mit Dünndarmbefall haben zudem ein erhöhtes Risiko an einem Dünndarmkarzinom (meist Adenokarzinome) zu erkranken. Bei refraktärer, langanhaltender und strikturierender Erkrankung oder relevanten Symptomen sollte daran gedacht werden. Ein routinemässiges Screening wird aktuell aber nicht empfohlen (9).
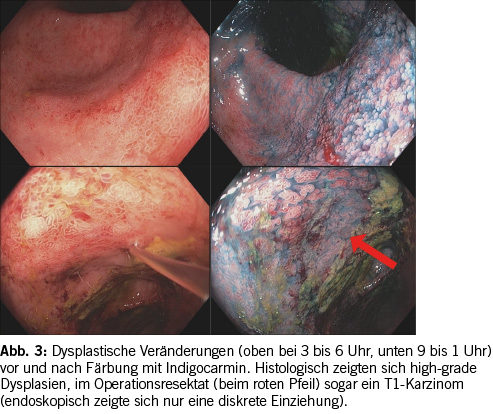
Vor der Zeit der hochauflösenden Endoskope (high definition endoscopy) wurde angenommen, dass es sich bei dysplastischen Läsionen, die als Vorstufen eines Karzinoms gelten, um nicht sichtbare Läsionen handelt. Aufgrund dessen wurden Random-Biopsien aus allen fünf Darmabschnitten empfohlen (alle 10 cm, Vier-Quadranten-Biopsien). Mit den neuen hochauflösenden Endoskopen können diese Dysplasien nun aber meistens gesehen werden, entsprechend erfolgte ein Paradigmen-Wechsel von Random-Biopsien zu gezielten (targeted) Biopsien/ Exzisionen (10). Somit ist es in der Screening-Koloskopie von grösster Wichtigkeit, dass man die Schleimhaut bei guter Vorbereitung mit hochauflösenden Geräten sehr genau und genügend lange inspiziert. Mit der Chromoendoskopie, bei der die Schleimhaut durch Farbstoffe wie Methylenblau oder Indigocarmin angefärbt wird, kann die Detektionsrate weiter erhöht werden. Der Einsatz der Chromoendoskopie wird grundsätzlich in Richtlinien empfohlen (1). Falls keine Chromoendoskopie zur Verfügung steht, empfehlen die ECCO-Guidelines zusätzlich zu Targeted-Biopsien auch Random-Biopsien zu entnehmen (1). Neuere Studien zeigten zudem, dass die virtuelle Chromoendoskopie (z.B. Narrow band imaging (NBI), das am häufigsten verwendete digitale Chromoendoskopieverfahren, welches kleinste Gefäss- und Schleimhautstrukturen darstellen kann), eine ähnlich gute Detektionsrate von Dysplasien hat wie die konventionelle Chromoendoskopie (9).
In Zukunft wird wohl auch die künstliche Intelligenz (artificial intelligence (AI)) einen Stellenwert im Dysplasie-Screening haben (wie auch in der Dokumentation der entzündlichen Aktivität und der Auswertung von Kapselendoskopien); standardmässig empfohlen wird sie derzeit aber noch nicht (11).
Das Intervall von Folgekoloskopien nach erster Screening-Koloskopie wird anhand einer Risikostratifikation durchgeführt, die der Tabelle 1 entnommen werden kann. Bei Hochrisikosituationen wie der PSC, nachgewiesenen Dysplasien innerhalb von 5 Jahren, Strikturen oder einer extensiven langandauernden Colitis mit schwerer Entzündung sind jährliche Koloskopien indiziert, während bei fehlenden Risikofaktoren wahrscheinlich ein fünfjährliches Intervall ausreichend ist (1).
Da Dysplasien mit den geschilderten modernen Verfahren meistens endoskopisch entdeckt werden können, hat sich die Therapie von Dysplasien (die von einem zweiten spezialisierten Pathologen bestätigt werden sollen) geändert. Früher war die Therapie der Wahl die Kolektomie. Heutzutage werden Dysplasien in endoskopisch resektabel und nicht resektabel eingestuft. Falls dies möglich erscheint, wird eine endoskopische Resektion angestrebt, die von einem erfahrenen Endoskopiker durchgeführt werden sollte (2).
Bei Patienten mit Low-grade-Dysplasien ohne endoskopisch verifizierte Läsion ist eine Chromoendoskopie innerhalb von drei Monaten indiziert. Die Kolektomie wird weiterhin empfohlen, wenn Dysplasien nicht reseziert werden können, es Hinweise für Dysplasien an der Basis der Läsion gibt oder nicht endoskopisch sichtbare high-grade Dysplasien oder multifokale low-grade Dysplasien bestehen (2, 9).
Postoperative Beurteilung nach Ileozökalresektion oder Proktokolektomie mit J-Pouch
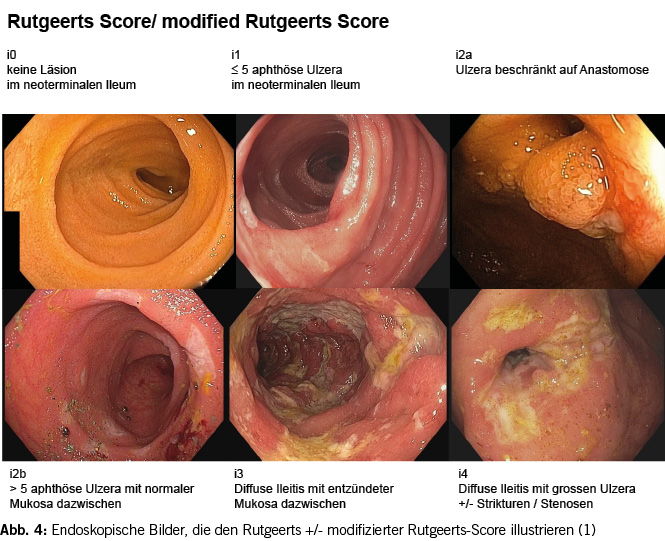
Beim Morbus Crohn mit stattgehabter Ileozökalresektion ist eine Ileo-Koloskopie nach 3 bis 6 (max.12) Monaten indiziert, um ein Rezidiv frühzeitig zu erkennen und gegebenenfalls zu therapieren. Als Score wird hier meistens der Rutgeerts-Score oder der modifizierte Rutgeerts-Score angewendet (siehe Abb. 4). Letzterer unterteilt die i2 Läsionen in i2a (Ulcera and der Anastomose) und i2b (≥ 5 Ulcera im neoterminalen Ileum). Diese Unterteilung erfolgt in Annahme der Hypothese, dass die Ulzerationen an der Anastomose mitunter ischämisch bedingt sind und somit nicht auf eine immunsuppressive Therapie ansprechen. Bislang konnte dies aber nicht sicher bewiesen werden. Allgemein empfehlen Guidelines ein exspektatives Procedere bei i1 und einen Therapiestart postoperativ bei i3/i4. Bei i2 muss von Fall zu Fall individuell entschieden werden (1).
Bei einem sehr aggressiven Verlauf mit Fisteln, jungen Personen mit IBD oder bereits mehrfach stattgehabten Operationen wird häufig direkt nach der Operation eine erneute biologische Therapie gestartet respektive fortgeführt.
Nach Durchführung eines ileoanalen J-Pouch (ileal anal pouch procedure (IAPP)) nach totaler Proktokolektomie bei Colitis ulcerosa können verschiedene Komplikationen auftreten. Es sind dies Dehiszenzen, Strikturen, Abszesse, ein Sinustrakt, Fisteln sowie die akute und chronische pouchitis und cuffitis. Je nach Klinik sind hier eine Schnittbildgebung und/ oder eine Endoskopie zur Beurteilung der Komplikation und Evaluation einer Therapie indiziert. Ganz wichtig ist hier die enge interdisziplinäre Zusammenarbeit. Auch nicht vergessen werden darf, dass im Bereich des Cuff, der aus Kolonschleimhaut besteht, ebenfalls Dysplasien oder ein Karzinom entstehen können. Einheitliche Guidelines zum postoperativen Intervall von Pouch-Endoskopien gibt es nicht. Insbesondere wenn die Kolektomie aber aufgrund von Dysplasien durchgeführt wurde, sollte daran gedacht und regelmässig (jährlich) eine Pouch-Endoskopie durchgeführt werden (2, 12).
Endoskopische Interventionen bei chronisch entzündlichen Darmerkrankungen
Resektion von Dysplasien
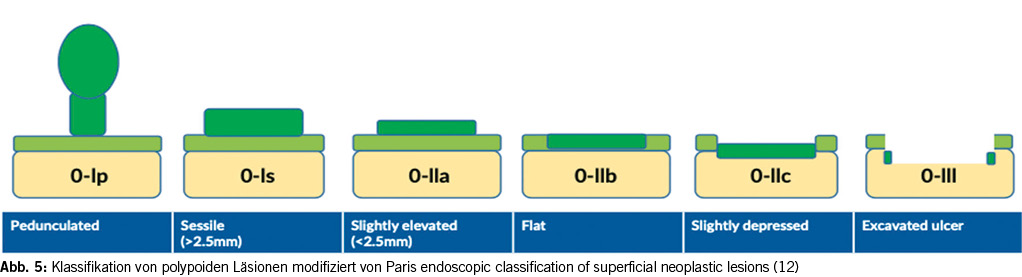
Historisch wurden endoskopische Läsionen bei Personen mit IBD als dysplasia-associated lesions or masses (DALM) bezeichnet. Dieser Begriff wurde aber mehr und mehr verlassen zugunsten einer besseren Charakterisierung der Läsion anhand der Paris Klassifikation (siehe Abb. 5). Dabei werden polypoide (sessil oder gestielt) von nicht polypoiden Läsionen (leicht erhaben, flach, eingesunken) unterschieden (13). Zudem ist wichtig zu beschreiben, ob die Läsion scharf oder unscharf begrenzt ist und innerhalb oder ausserhalb der Ausdehnung der Colitis auftritt (10). Ulzerationen, Einziehungen oder das fehlende Anheben nach einer Injektion (non-lifting-sign) sind Zeichen einer submukosalen Invasion (2).
Bestehen keine Hinweise auf eine submukosale Invasion und ist die Läsion abgrenzbar, sollte eine endoskopische Resektion angestrebt werden. Läsionen ausserhalb der Ausdehnung der bekannten Colitis werden wie sporadische Adenome reseziert. Liegen sie innerhalb der Ausdehnung der Colitis kann die Resektion erschwert sein, da aufgrund der chronischen Entzündung eine submukosale Fibrose bestehen kann und somit ein Anheben der Läsion (sog. Lifting) erschwert sein kann. In diesen Fällen sind fortgeschrittene Resektionstechniken wie die endoskopische Mukosa-Resektion (EMR) und endoskopisch submukosale Dissektion (ESD), die nur von geübten Untersuchern durchgeführt werden sollten, indiziert (2).
Dabei gilt es einige Grundsätze zu beachten (2):
– Eine en bloc Resektion sollte angestrebt werden, um histologisch eine komplette Resektion bestätigen zu können. Es wird zudem empfohlen, neben der Abtragungsstelle Biopsien mit der Frage nach Rest-Dysplasien zu entnehmen.
– Eine komplette Resektion sollte, wenn immer möglich, in der ersten Sitzung erfolgen, da bei Folgeinterventionen die Fibrosebildung grösser ist und somit die komplette Resektion weiter erschwert wird.
Besteht keine Expertise in den genannten Resektions-Techniken, sollte eine Zuweisung an ein spezialisiertes Zentrum erfolgen. Wichtig ist dabei, dass die Läsion nicht biopsiert wird, da sich mit der damit verbundenen Fibrose die nachfolgende Resektion erschwert. Hilfreich ist es jedoch, wenn die Läsion möglichst genau charakterisiert (z.B. Lage, Grösse, Erreichbarkeit, Paris- Klassifikation) und mittels eines Clips und Tusche markiert wird. In all diesen Situationen bleibt die Kolektomie eine valable Option und sollte im Sinne einer shared decision making mit den Patientinnen und Patienten besprochen werden (1).
Wird eine dysplastische Läsion reseziert, sollten engmaschig Verlaufskoloskopien durchgeführt werden, um die komplette Resektion bestätigen zu können und ggf. weitere Läsionen zu entdecken. Diese sollten innerhalb des ersten Jahres 3-6-monatlich, dann jährlich erfolgen (2, 9).
Evaluation und Behandlung von Strikturen und Stenosen
Beim Morbus Crohn können Strikturen/ Stenosen im Dünn- oder Dickdarm und insbesondere auch nach einer Ileozökalresektion im Bereich der Anastomose auftreten. Auch bei der Colitis ulcerosa sind Strikturen und Stenosen im Kolon möglich, wobei hier wie oben erwähnt immer zuerst ein Karzinom ausgeschlossen werden muss (1).
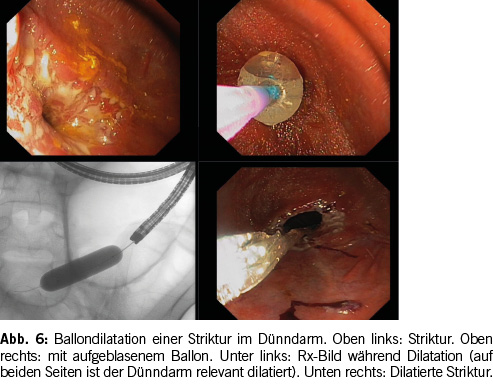
Die endoskopische Ballondilatation ist eine gute Alternative zu chirurgischen Interventionen wie der Strikturoplastie oder Resektion. Erfolgversprechend und sicher sind Ballondilatation von kurzen (≤ 5 cm) Fibrostenosen mit nur minimaler Entzündung und ohne Angulation (in Linie mit dem Darm) und fehlender Fistelöffnung in der Nähe. Um das Risiko einer Perforation zu minimieren, erfolgt die Ballondilatation schrittweise, ggf. in mehreren Sitzungen, wobei eine Ballondilatation von 20 mm nicht überschritten werden sollte. Beschränkt man sich auf solche Situationen, ist eine Ballondilatation relativ sicher mit einer Perforationsrate < 5 % (2).
Eine Pouch-Striktur nach IAPP ist ebenfalls eine gute Indikation für eine Ballondilatation. Endoskopische Strikturotomien/ -plastien mittels eines Needle-knife und Stents mögen in gewissen Situationen einen Stellenwert haben (14), können aber nicht routinemässig empfohlen werden. Lokale Steroid- oder Biologika-Injektionen werden nicht empfohlen (15).
Evaluation und Behandlung von Fisteln
Neben dem MRI des Beckens ist die Untersuchung in Anästhesie und die Endosonographie ein wichtiges Instrument, um perianale Fisteln zu evaluieren. Oft werden diese Untersuchungen durch die Kollegen der Chirurgie durchgeführt. Die endoskopische Beurteilung des Rektums ist aber sehr wichtig, hat sie doch einen relevanten Einfluss auf die Therapie. Die antiinflammatorische medikamentöse Therapie des entzündeten Rektums, ist ein wichtiges Standbein der Therapie des perianal fistulierenden Morbus Crohn (1). Endoskopische Fistulotomien mit dem Needle-knife, Fistelverschlüsse sowie endosonographisch gesteuerte Abszess-Drainagen sind beschrieben und in sehr ausgewählten Fällen allenfalls eine Alternative zur Chirurgie (14, 16).
Endoskopische Behandlung einer IBD-assoziierten primär sklerosierenden Cholangitis
Die primär sklerosierende Cholangitis (PSC) tritt in 2-8% bei Patienten mit einer IBD auf und sollte bei Vorliegen einer cholestatischen Hepatopathie, Pruritus oder perihilärer Lymphadenopathie mittels Magnetresonanz-Cholangiopankreatikographie (MRCP) gesucht werden (17). Die PSC kann in eine Leberzirrhose fortschreiten, und das Risiko eines hepatobiliären (400-fach) oder kolorektalen Karzinoms (HR 2.4) ist erhöht. Eine hepatologische Anbindung ist aufgrund dessen empfohlen (17).
Findet sich im MRCP eine dominante Striktur, ist eine endoskopische retrograde Cholangiopankreatikographie (ERCP) zur Gewebegewinnung einerseits und zur Stenosedilatation andererseits indiziert. Heutzutage wird bei diesen Fragen an entsprechenden Zentren die ERCP mit einer Cholangioskopie (SpyGlass DS IITM , Boston Scientific Corp., MA, USA) kombiniert, wobei mit dieser die Stenose optisch charakterisiert und unter Sicht biopsiert werden kann. Damit erhöht sich die Sensitivität für die Diagnose eines Cholangiokarzinoms markant. Aufgrund des erhöhten Komplikationsrisikos bei Vorliegen einer PSC ist, wenn immer möglich, die MRCP einer ERCP vorzuziehen, solange es sich um rein diagnostische Aspekte handelt (18).
Oberarzt Klinik für Gastroenterologie und Hepatologie
Klinik für Gastroenterologie/ Hepatologie
Kantonsspital St. Gallen
Samuel.Truniger@kssg.ch
Der Autor hat keine Interessenkonflikte.
Dank: Mithilfe bei der Bildauswahl durch Dr. med. Gian Marco Semadeni, Dr. med. Marius König, Dr. med. Joel Dütschler und Dr. med. Houman Azam.
Schlussfolgerung
Endoskopische Untersuchungen haben bei der Diagnostik, Verlaufsbeurteilung und Therapie von IBD-Patienten eine zentrale Bedeutung. Dank neuer Untersuchungsmethoden und high definition endoscopy gewinnt die moderne interventionelle Endoskopie an Bedeutung und stellt teilweise eine Alternative zu operativen Massnahmen dar, die im Sinne eines shared decision making mit den Patientinnen und Patienten besprochen werden sollten.
1. Maaser C, Sturm A, Vavricka SR, Kucharzik T, Fiorino G, Annese V, et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J Crohns Colitis. 2019;13(2):144-64.
2. Shergill AK, Lightdale JR, Bruining DH, Acosta RD, Chandrasekhara V, Chathadi KV, et al. The role of endoscopy in inflammatory bowel disease. Gastrointest Endosc. 2015;81(5):1101-21.e1-13.
3. Bakman Y, Katz J, Shepela C. Clinical significance of isolated peri-appendiceal lesions in patients with left sided ulcerative colitis. Gastroenterology Res. 2011;4(2):58-63.
4. Turner D, Ricciuto A, Lewis A, D‘Amico F, Dhaliwal J, Griffiths AM, et al. STRIDE-II: An update on the selecting therapeutic targets in inflammatory bowel disease (STRIDE) Initiative of the international organization for the study of IBD (IOIBD): Determining therapeutic goals for treat-to-target strategies in IBD. Gastroenterology. 2021;160(5):1570-83.
5. Rubin DT, Ananthakrishnan AN, Siegel CA, Sauer BG, Long MD. ACG clinical guideline: Ulcerative colitis in adults. Am J Gastroenterol. 2019;114(3):384-413.
6. Annunziata ML, Caviglia R, Papparella LG, Cicala M. Upper gastrointestinal involvement of Crohn‘s disease: a prospective study on the role of upper
endoscopy in the diagnostic work-up. Dig Dis Sci. 2012;57(6):1618-23.z
7. Silverberg MS, Satsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol. 2005;19 Suppl A:5A-36A.
8. Peyrin-Biroulet L, Sandborn W, Sands BE, Reinisch W, Bemelman W, Bryant RV, et al. Selecting therapeutic targets in inflammatory bowel disease (STRIDE): Determining therapeutic goals for treat-to-target. Am J Gastroenterol. 2015;110(9):1324-38.
9. Gordon H, Biancone L, Fiorino G, Katsanos KH, Kopylov U, Al Sulais E, et al. ECCO Guidelines on inflammatory bowel disease and malignancies. J Crohns Colitis. 2023;17(6):827-54.
10. Laine L, Kaltenbach T, Barkun A, McQuaid KR, Subramanian V, Soetikno R. SCENIC International consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology. 2015;148(3):639-51.e28.
11. Stidham RW, Takenaka K. Artificial intelligence for disease assessment in inflammatory bowel disease: How will it change our practice? Gastroenterology. 2022;162(5):1493-506.
12. Shen B, Kochhar GS, Rubin DT, Kane SV, Navaneethan U, Bernstein CN, et al. Treatment of pouchitis, Crohn‘s disease, cuffitis, and other inflammatory disorders of the pouch: consensus guidelines from the International Ileal Pouch Consortium. Lancet Gastroenterol Hepatol. 2022;7(1):69-95.
13. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc. 2003;58(6 Suppl):S3-43.
14. Shen B. Principles, preparation, indications, precaution, and damage control of endoscopic therapy in inflammatory bowel disease. Gastrointest Endosc Clin N Am. 2022;32(4):597-614.
15. Rieder F, Latella G, Magro F, Yuksel ES, Higgins PD, Di Sabatino A, et al. European Crohn‘s and Colitis organisation topical review on prediction, diagnosis and management of fibrostenosing Crohn‘s disease. J Crohns Colitis. 2016;10(8):873-85.
16. Kochhar G, Shen B. Endoscopic fistulotomy in inflammatory bowel disease (with video). Gastrointest Endosc. 2018;88(1):87-94.
17. Gordon H, Burisch J, Ellul P, Karmiris K, Katsanos K, Allocca M, et al. ECCO Guidelines on extraintestinal manifestations in inflammatory bowel disease. J Crohns Colitis. 2023.
18. Aabakken L, Karlsen TH, Albert J, Arvanitakis M, Chazouilleres O, Dumonceau JM, et al. Role of endoscopy in primary sclerosing cholangitis: European Society of Gastrointestinal Endoscopy (ESGE) and European Association for the Study of the Liver (EASL) Clinical Guideline. Endoscopy. 2017;49(6):588-608.
Therapeutische Umschau
- Vol. 80
- Ausgabe 9
- Dezember 2023