- Neue Behandlungsmöglichkeiten in der Systemtherapie beim Mammakarzinom und damit verbundene neue Nebenwirkungen
Das Mammakarzinom hat heute eine deutlich bessere Prognose als noch vor zwei bis drei Dekaden. Die Behandlungsoptionen wurden deutlich verbessert. Durch neue Systemtherapie sind aber auch Nebenwirkungen hinzugekommen, die der Kliniker erst kennen lernen muss, um sie optimal behandeln zu können. Der vorliegende Artikel gibt einen Überblick über die wichtigsten Neuerungen der letzten 10 Jahre im Bereich der Systemtherapie und zeigt auch die wichtigsten Nebenwirkungen und deren Management auf.
Einführung
In der Schweiz erkranken pro Jahr rund 6.000 Frauen und 30-50 Männer an Brustkrebs. Die Sterberate an Brustkrebs liegt dabei bei 1300 Frauen pro Jahr. (1) In den letzten Jahrzehnten hat sich die Prognose deutlich gebessert durch verschiedene Faktoren wie beispielweise: Screening Mammographien, optimale Radiotherapie und auch Verbesserungen in der molekularen Diagnostik und in der Systemtherapie. Weltweit geht man heute von einer Heilungsrate in den westlichen Ländern von rund 85% aus. (2) Durch schonendere und strikter indizierte lokale und systemische Behandlungen wurden die Morbidität reduziert und die Lebensqualität verbessert.
Sollte es zu einem Rezidiv mit Metastasen kommen, gibt es heute bessere Behandlungsmöglichkeiten einschliesslich molekular basierter Therapien und zielgerichteter Therapien. Die Behandlung des frühen wie auch metastasierten Mammakarzinoms basiert weiterhin auf den intrinsischen Subtypen: (3)
a) Luminal A
b) Luminal B
c) Triple negativer Brustkrebs
d) HER2 positiver Brustkrebs
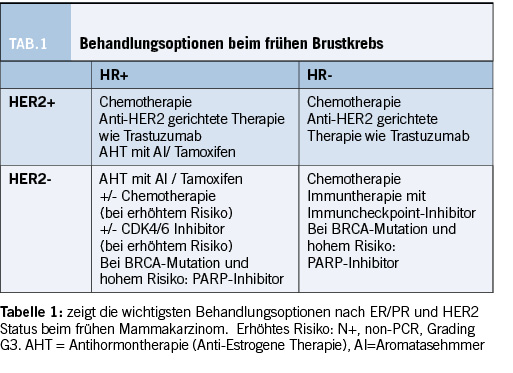
Die wichtigsten Behandlungen umfassen die anti-estrogene Therapie, Chemotherapie und zielgerichtete Therapie sowie Immuntherapie mit Immun-Checkpoint-Inhibitor. Tabelle 1 gibt einen Überblick über die wichtigsten Behandlungsoptionen beim frühen Mammakarzinom. (4, 5)
Bei den metastasierten Tumorerkrankungen sind weitere molekulare Marker hinzugekommen: BRCA-Status, PDL-1 Status, ESR – Status und PIK3CA Status und HER2-low Status. Anhand dieser Marker kann häufig eine zielgerichtete Therapie empfohlen werden mittels PARP-Inhibitoren, Immuncheck-Point-Inhibitoren, selektiven Estrogenrezeptor-Downregulators (SERDS), PIK3CA-Inhibitoren und Antikörper-Drug-Konjugaten. (6, 7)
In den letzten 10 Jahren haben sich in der Systemtherapie des frühen wie auch fortgeschrittenen Mammakarzinoms zahlreiche Neuerungen ergeben.(8) Durch die neuen Substanzen musste allerdings auch neue Toxizität in Kauf genommen werden. Bei der Medikamentenentwicklung im Bereich Brustkrebs sind heute in vielen Studien auch Erhebung der Lebensqualität mittels «Patient reported outcomes» anhand von standardisierten Fragebögen selbstverständlich geworden.(9) Beim Management der verschiedenen Nebenwirkungen und Lebensqualitätsassessments werden heute auch elektronische Patientenprogramme, sogenannte eHealth Apps eingesetzt. Diese können frühzeitig zu einer Verbesserung der Arzt-Patientenkommunikation führen und sogar die Prognose verbessern. (10-12) (Abbildung 1)
Die am amerikanischen Krebskongress vorgestellte multizentrische, randomisierte Phase-IV «PreCycle» Studie untersuchte bei Patientinnen mit metastasiertem Brustkrebs, die eine Behandlung mit Palbociclib plus Aromatasehemmer oder Palbociclib plus Fulvestrant erhielten, die Rolle einer solchen Patienten-App.(13,14) In den Jahren 2017 und 2021 wurden 499 Patientinnen 2:1 in den aktiven (CANKADO PRO-React; Arm A) oder inaktiven (CANKADO Inform; Arm B) Arm randomisiert. Der primäre Endpunkt war die Zeit bis zur Verschlechterung der Lebensqualität (TTD QoL). Bei allen Patientinnen wurde ein signifikant verringertes Risiko für den aktiven CANKADO-Arm A hinsichtlich der TTD QoL gezeigt (p = 0,03). Das mediane progressionsfreie Überleben lag bei 21,4 Monate im Arm A und 18,7 Monate im Arm B. Das mediane Gesamtüberleben wurde im Arm A nicht erreicht und war bei 42,6 Monaten im Arm B.
Zusätzlich können eHealth Anwendungen die Therapiekontrollen erleichtern und auch der Patientin mit Mammakarzinom eine verbesserte Kommunikation mit dem Spital und eine bessere Informationsquelle ermöglichen.
Neue Systemtherapieoptionen beim frühen Mammakarzinom und das Management der Nebenwirkungen
Sowohl beim TNBC als auch beim HER2-positiven Mammakarzinom wird häufig eine neo-adjuvante Chemotherapie appliziert, die bei letzterem mit Antikörpern kombiniert wird.(15) Der Vorteil des neo-adjuvanten Konzepts beinhaltet: Prognostische Information, Verkleinerung des Tumors, Zeitgewinn für die genetische Testung und Verbesserung der Therapieentscheide nach Remissionsstatus. In der Regel werden 6-8 Zyklen Chemotherapie appliziert vor der Operation und die Antikörper werden auch nach der Operation weiter verabreicht.
Beim frühen HER2+ Mammakarzinom empfehlen heute viele Onkolog*Innen eine anthracyline-freie Chemotherapie in Kombination mit Trastuzumab und Pertuzumab. Dabei können pathologisch komplette Remissionen bis zu 60% erreicht werden. (16, 17) Besseres Ansprechen erreichen Tumore, bei denen hohe Tumor-infiltrierende Lymphozyten nachzuweisen sind.(18) Durch die anthracyline-freien Regime ist das Risiko für Chemotherapie-assoziierte Leukämien deutlich geringer und auch das Risiko für eine anthracyline-induzierte Kardiopathie fehlt. Allerdings müssen Patientinnen bei HER2-gerichteter Therapie weiterhin kardiologisch monitorisiert werden. Nach den aktuellen ESC Guidelines soll zu Beginn der Therapie eine Risikostratifizierung erfolgen. (19) Alle Patientinnen sollten als Baseline ein transthorakales Echokardiogramm (TTE), EKG und Labor mit Troponin und NT-proBNP erhalten. Während der Trastuzumab-basierten Therapie sollten TTE und Labor alle 3 Monate wiederholt werden. Nach der Therapie sollte für die «High-risk» Patientinnen nach 3 Monaten und 12 Monaten ein TTE und Labor erfolgen, für die «Low-risk» Patientinnen sollte 12 Monate post-Therapie noch ein TTE und Labor erfolgen.
Bei kompletter pathologischer Remission sollte nur die Antikörpertherapie weiter verabreicht werden. Dabei sollte das kardiologische Monitoring wie oben beschrieben weitergemacht werden. Sollte es nicht zu einer kompletten pathologischen Remission kommen, sollte eine Therapie mit Trastuzumab-Emtansine (T-DM1) durchgeführt werden. In der KATHERINE Studie war die Therapie mit T-DM1 einer alleinigen Trastuzumab-Erhaltungstherapie bei non-pCR deutlich überlegen. Somit ist T-DM1 heute der Standard bei Patientinnen mit HER2+ Mammakarzinom, die keine komplette Remission erreichen. Die Verträglichkeit von T-DM1 ist in der Regel gut, die häufigsten Nebenwirkungen in der KATHERINE Studie waren Blutbildveränderungen mit Thrombozytopenie.(20)
Beim frühen TNBC die neo-adjuvante Chemotherapie mit einem Immuncheckpoint-Inhibitor Pembrolizumab kombiniert. Die Hinzunahme des Pembrolizumab hatte die komplette Remissionsrate um rund 15% Punkte verbessert und auch die Rate an Rezidiven deutlich verringert. Der Effekt war unabhängig vom PDL-1 Status. Bei hoher Anzahl an TILs war der Effekt für eine pCR höher und auch unabhängig von der PDL-1 Blockade.(21, 22)
In der Phase II Studie GeparNueovo wurde eine neo-adjuvante Chemotherapie mit Durvalumab -einem PDL-1 Checkpoint-Inhibitor- ebenfalls in neo-adjuvanter Absicht untersucht. In dieser Phase II Studie fand sich ein signifikanter Effekt auf das Gesamtüberleben bei noch kurzem Follow-up. (23)
Die Immuntherapie wurde mittlerweile zum Standard beim TNBC mit mindestens 2 cm Durchmesser und/oder Lymphknotenbefall, weil es dort entscheidend zur Prognoseverbesserung beiträgt. Offen bleibt, ob auch für kleinere Tumoren von einer Chemo-Immuntherapie ein Nutzen erbracht werden kann.(22)
Nebenwirkungen der Immuntherapie sind im Vergleich zur Chemotherapie verschieden. Dabei ist die Interaktion zwischen T-Zellen und Tumor, sowie auch eigenem «Körpergewebe» wichtig. Bei der Blockade der Immuncheckpoint-Pathways kommt es zu einer generalisierten Aktivierung von T-Zellen. Die Checkpoints der T-Zellen helfen Autoimmunität und Toleranz zu vermeiden und das Immunsystem sozusagen zu kontrollieren. (24) Die Therapie mit Immun-Checkpoint-Inhibitoren ist mittlerweile eine der wichtigsten Therapien im Bereich der soliden Onkologie und Standardtherapie für das maligne Melanom, Bronchuskarzinom, Mikrosatelliten-defiziente Tumore (z.B. Endometriumkarzinom, Kolorektalkarzinom) und anderer.
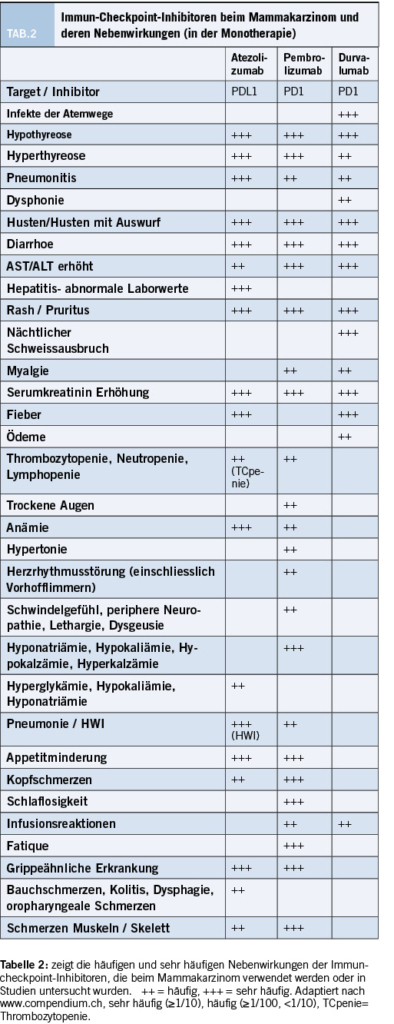
Schwere immunvermittelte Nebenwirkungen sind gelegentlich zu finden (10-15%), können dosisabhängig sein und führen häufig zu Abbruch der Therapie. Zu den am häufigsten beobachteten Nebenwirkungen von Immuncheckpoint-Inhibitoren zählen Hautreaktionen wie Rash, Vitiligo und andere Hautveränderungen. Zudem kommt es häufiger zu Diarrhoe durch immunvermittelte Colitiden. Eine weitere häufige Manifestation von immunvermittelten Nebenwirkungen ist eine Hyperthyreose, die im Verlauf zu einer Hypothyreose führt. Selten kann es zu schwerwiegenderen Fällen und Entzündungen in Organen wie der Lunge oder der Leber kommen, die lebensbedrohlich sein können.(24) Es ist wichtig, dass dann schnell eine Behandlung mit Immunsuppressiva wie Kortikosteroiden eingeleitet wird. Tabelle 2 gibt einen Überblick der wichtigsten immunvermittelten Nebenwirkungen bei verschiedenen Immun-Checkpoint-Inhibitoren, die beim Mammakarzinom eingesetzt werden.
Bei der Behandlung der immunvermittelten Nebenwirkungen gibt es mittlerweile zahlreiche Empfehlungen und lokale Richtlinien, die den Klinikern helfen. (25, 26) In der Regel wird das Absetzen oder Pausieren empfohlen, bis die Nebenwirkung sich verbessert oder aufgelöst hat. Je nach Schweregrad wird auch ein dauerhaftes Sistieren der Therapie mit Immuncheckpoint-Inhibitor empfohlen. Therapeutisch werden Steroide lokal oder systemisch sowie verschiedene Immunsuppressive empfohlen (z.B. Infliximab oder Mycophenolat-Mofetil).
Neue Systemtherapieoptionen beim fortgeschrittenen Mammakarzinom und das Management der Nebenwirkungen
Beim fortgeschrittenen Mammakarzinom hat sich in den letzten 10 Jahren eine erhebliche Verbesserung der therapeutischen Möglichkeiten und Prognose ergeben. Molekulare Therapien und antikörperbasierte Therapien sind mittlerweile in den klinischen Alltag eingezogen.
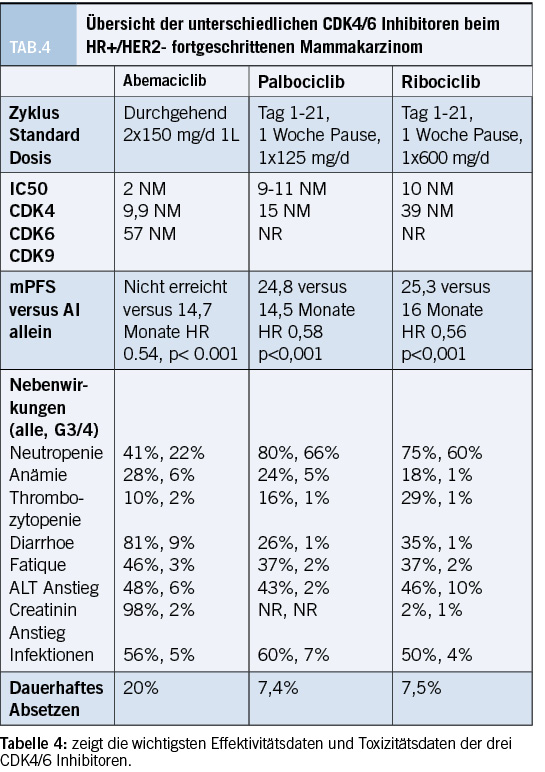
Beim HR+/HER2- metastasierten Mammakarzinom sind bereits seit einigen Jahren die CDK4/6 Inhibitoren zugelassen. Die Medikamente blockieren die «Cycline-dependent Kinase -4 und -6» und verhindern so eine Komplexbildung mit Cycline D und dies führt zu einer Phosphorylierung des Retinoblastom-Proteins und zum Stoppen des Zellzyklus in der G1/S- Phase. Es gibt mittlerweile drei zugelassene CDK4/6 Inhibitoren (Abemaciclib, Palbociclib, Ribociclib), welche in Kombination mit endokriner Therapie in der 1st Line und 2nd Line beim HR+/HER2- Mammakarzinom zugelassen sind.(27-29) In den Zulassungsstudien haben die Medikamente das progressionsfreie Überleben mit allen drei Substanzen verdoppelt gegenüber der alleinigen endokrinen 1st Line Therapie. In der kürzlich veröffentlichten OS-Analyse der MONALEESA-2 Studie, welche Ribociclib plus Letrozol untersuchte, konnte gegenüber Letrozol alleine ein signifikanter Überlebensvorteil gezeigt werden. (63,9 gegenüber 51,4 Monate, p=0,008) (30)
In der Regel sind CDK4/6 Inhibitoren sehr gut verträgliche Medikamente, jedoch bestehen einige spezifische Nebenwirkungen, die jedoch durch Dosisanpassungen optimiert werden können. Tabelle 4 gibt die wichtigsten Eigenschaften des Medikamentes und die Toxizität wieder. (31)
Am Amerikanischen Krebskongress in Chicago wurden dieses Jahr erstmalig die Daten der SONIA Studie vorgestellt. Dies ist eine Phase III Studie mit 1050 Patientinnen, welche untersuchte, ob die Verschiebung des CDK4/6 Inhibitors in die 2nd Line die Prognose verschlechtert. Letztendlich hatte die 2nd line Therapie mit dem CDK4/6 Inhibitor Palbociclib keinerlei Auswirkung auf die Gesamtprognose der Patientinnen. Es erscheint wichtig, solche Sequenzierungsstudien durchzuführen, die Daten der CDk4/6 Inhibitoren besonders des Ribociclib in der 1st line sind so stark, dass aus unserer Sicht sich draus noch kein «Practice Change» ergibt.(32)
Eine weitere wichtige noch relativ neue Substanzklasse sind die sogenannten Antikörper-Medikamenten-Konjugate (ADCs). Die Idee hinter ADCs besteht darin, dass ein Antikörper an ein speziell ausgewähltes «Target» der Tumorzelle bindet und anschließend die an den Antikörper gebundene Chemotherapie (Payload) freisetzt, um die Tumorzelle zu zerstören.(33) Der Antikörper wird so konstruiert, dass er spezifisch an die Tumorzellen bindet. Dadurch soll verhindert werden, dass gesunde Zellen geschädigt werden. Die Verbindung zwischen dem Chemotherapie-Molekül und dem Antikörper, der sogenannte Linke, sorgt dafür, dass die Chemotherapie zielgenau an den Tumorzellen «abgeladen» wird. ADCs können bei vielen Arten von Krebserkrankungen eingesetzt werden. Beim fortgeschrittenen Mammakarzinom sind zurzeit drei Substanzen in der Schweiz zugelassen: Trastuzumab-Emtansin (T-DM1), Trastuzumab-Deruxtecan (T-DXd) und Sacituzumab-Govitecan(SG).(34-36) Das Trastuzumab-Emtansine wird sowohl beim frühen wie auch beim metastasierten HER2+ Mammakarzinom eingesetzt. Beim metastasierten HER2+ Mammakarzinom wurde sowohl das PFS als auch das OS in der 2nd Line nach Taxan- und Trastuzumab-haltiger Chemotherapie verlängert (EMILIA Studie).(37)
Das Medikament Trastuzumab-Deruxtecan (T-DXd) hat allerdings im direkten «Head-to-Head» Vergleich ein höheres Ansprechen, längeres PFS und OS gezeigt gegenüber dem Trastuzumab-Emtansin und ist seither der neue Standard in der 2nd Line Behandlung des HER2+ metastasierten Mammakarzinoms. Mittlerweile wurde in einer Phase III Destiny-Breast004 gezeigt, dass T-DXd beim HER2-low fortgeschrittenen Mammakarzinom besser war als eine Standardchemotherapie. (38) HER2-low wurde dabei als eine Immunhistochemie 1+ oder 2+ definiert. Insgesamt wurden in die Studie 557 Patientinnen randomisiert, insgesamt waren 494 (88,7%) HR+/HER2-low. In der IIT war das PFS 10,1 versus 5,4 Monate für T-DXd bzw. Chemotherapie nach Investigator-Entscheid (TPC) (HR 0,51, p<0,001). Auch das OS war in der T-DXd Gruppe besser als in der TPC Gruppe (23,4 versus 16,8 Monate HR 0,64 p=0,001).
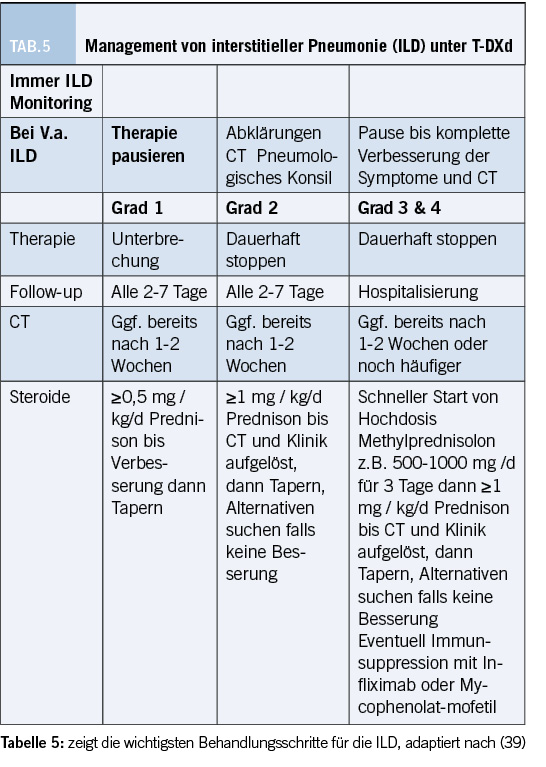
Die Gesamtrate an Grad 3 oder höher Toxizität lag bei T-DXd bei 52,6 Monaten. Die Gesamtrate an interstitieller Lungenerkrankung (ILD) lag bei 12,9%. Grad 5 Events traten in 0,8% der Population auf. Die Lungentoxizität ist problematisch und zwischenzeitlich gibt es spezielle Algorithmen für das Management.(39)
Tabelle 5 zeigt das Management der ILD unter T-DXd auf.
Weitere häufige Nebenwirkungen umfassen: Nausea, Vomitus, Neutropenie, Infusion-vermittelte Reaktionen, Alopezie, Fatigue und reduzierte kardiale EF. Die Nebenwirkungen sollten mit den bekannten supportiven Therapien, wie für die Chemotherapie behandelt werden:
Nausea, Vomitus: 5HT3, Dexamethason, Aprepitant allenfalls Olanzapin
Neutropenie: G-CSF Support
Infusionsreaktionen: Ranitidin, Dexamethason, Hydrocortison i.v.
Fatigue: Ursachensuche
EF-Reduktion: Pause der Therapie, allenfalls ACE-Hemmer, nur bei Erholung wieder starten.
Zusammenfassung und Schlussbemerkung
Die Behandlung des Mammakarzinoms hat sich in den letzten Jahren deutlich verbessert, auch im Bereich der Systemtherapie. Neue Medikamente ergänzen die bisherigen Therapien wie endokrine Therapie oder Chemotherapie. Insbesondere im Bereich der modernen Immuntherapie bestehen andere Nebenwirkungen als mit der klassischen Chemotherapie. Der Kliniker muss lernen, diese Nebenwirkungen zu erkennen und zu managen. Behandlungsoptimierung und Behandlungsdeeskalation ist derzeit ein wichtiges Forschungsthema. Medizinische eHealth Anwendungen können die QoL/PROMs von Patienten besser monitorisieren und durch intelligente AI-basierte Algorithmen allenfalls auch die Prognose verbessern – durch frühzeitige Entdeckung von medizinischen Problemen oder Toxizität. Verschiedene neue Substanzklassen wie CDK4/6 Inhibitoren oder ADCs benötigen zudem ein gutes Monitoring, die Apps können allenfalls helfen auch die Visiten im Spital zu vermindern und dadurch der Patientin mehr Autonomie zuzugestehen.
In Zukunft wird wahrscheinlich eine nochmals besser zugeschnittene Therapie auf die Patientin aber auch auf das Mammakarzinom eine gesteigerte Effektivität und Verträglichkeit aufweisen.
Medizinische Onkologie
Universitätsspital Basel
Petersgraben 5
4053 Basel
Schweiz
julia.landin@usb.ch
Department Brust, Abdomen und Becken
Universitätsspital Basel
Spitalstrasse 21
4053 Basel
Schweiz
walter.weber@usb.ch
Zentrum Onkologie und Hämatologie
Tumorzentrum Baselland
Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
Schweiz
marcus.vetter@ksbl.ch
1. Bundesamt für Statistik https://www.bfs.admin.ch/bfs/de/home/statistiken/gesundheit/gesundheitszustand/krankheiten/krebs/spezifische.html
2. Miller KD, Nogueira L, Devasia T, Mariotto AB, Yabroff KR, Jemal A, Kramer J, Siegel RL. Cancer treatment and survivorship statistics, 2022. CA Cancer J Clin. 2022 Sep;72(5):409-436.
3. Burstein HJ, Curigliano G, Thürlimann B, Weber WP, Poortmans P, Regan MM, Senn HJ, Winer EP, Gnant M; Panelists of the St Gallen Consensus Conference. Customizing local and systemic therapies for women with early breast cancer: the St. Gallen International Consensus Guidelines for treatment of early breast cancer 2021. Ann Oncol. 2021 Oct;32(10):1216-1235.
4. Cardoso F, Kyriakides S, Ohno S, Penault-Llorca F, Poortmans P, Rubio IT, Zackrisson S, Senkus E; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019 Aug 1;30(8):1194-1220.
5. Gennari A, André F, Barrios CH, Cortés J, de Azambuja E, DeMichele A, Dent R, Fenlon D, Gligorov J, Hurvitz SA, Im SA, Krug D, Kunz WG, Loi S, Penault-Llorca F, Ricke J, Robson M, Rugo HS, Saura C, Schmid P, Singer CF, Spanic T, Tolaney SM, Turner NC, Curigliano G, Loibl S, Paluch-Shimon S, Harbeck N; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021 Dec;32(12):1475-1495
6. Verret B, Bottosso M, Hervais S, Pistilli B. The Molecular Predictive and Prognostic Biomarkers in Metastatic Breast Cancer: The Contribution of Molecular Profiling. Cancers (Basel). 2022 Aug 30;14(17):4203
7. Denkert C, Seither F, Schneeweiss A, Link T, Blohmer JU, Just M, Wimberger P, Forberger A, Tesch H, Jackisch C, Schmatloch S, Reinisch M, Solomayer EF, Schmitt WD, Hanusch C, Fasching PA, Lübbe K, Solbach C, Huober J, Rhiem K, Marmé F, Reimer T, Schmidt M, Sinn BV, Janni W, Stickeler E, Michel L, Stötzer O, Hahnen E, Furlanetto J, Seiler S, Nekljudova V, Untch M, Loibl S. Clinical and molecular characteristics of HER2-low-positive breast cancer: pooled analysis of individual patient data from four prospective, neoadjuvant clinical trials. Lancet Oncol. 2021 Aug;22(8):1151-1161.
8. Miglietta F, Bottosso M, Griguolo G, Dieci MV, Guarneri V. Major advancements in metastatic breast cancer treatment: when expanding options means prolonging survival. ESMO Open. 2022 Apr;7(2):100409. doi: 10.1016/j.esmoop.2022.100409. Epub 2022 Feb 26. Erratum in: ESMO Open. 2022 Apr 7;7(3):100472. PMID: 35227965; PMCID: PMC8886005.
9. Javan Biparva A, Raoofi S, Rafiei S, et alGlobal quality of life in breast cancer: systematic review and meta-analysisBMJ Supportive & Palliative Care Published Online First: 16 June 2022. doi: 10.1136/bmjspcare-2022-003642
10. Wright A. Evaluation of two mobile health apps for patients with breast cancer using the Mobile Application Rating Scale. Mhealth. 2021 Oct 20;7:60. doi: 10.21037/mhealth-20-161. PMID: 34805391; PMCID: PMC8572758.
11. Yang S, Bui CN, Park K. Mobile Health Apps for Breast Cancer: Content Analysis and Quality Assessment. JMIR Mhealth Uhealth. 2023 Feb 23;11:e43522. doi: 10.2196/43522. PMID: 36821352; PMCID: PMC9999256.
12. Hou IC, Lan MF, Shen SH, Tsai PY, Chang KJ, Tai HC, Tsai AJ, Chang P, Wang TF, Sheu SJ, Dykes PC. The Development of a Mobile Health App for Breast Cancer Self-Management Support in Taiwan: Design Thinking Approach. JMIR Mhealth Uhealth. 2020 Apr 30;8(4):e15780. doi: 10.2196/15780. PMID: 32352390; PMCID: PMC7226037.
13. Degenhardt T, Fasching PA, Lüftner D, Müller V, Thomssen C, Schem C, Witzel I, Decker T, Tesch H, Kümmel S, Uleer C, Wuerstlein R, Hoffmann O, Warm M, Marschner N, Schinköthe T, Kates RE, Schumacher J, Otremba B, Zaiss M, Harbeck N, Schmidt M; PreCycle Investigators. PRECYCLE: multicenter, randomized phase IV intergroup trial to evaluate the impact of eHealth-based patient-reported outcome (PRO) assessment on quality of life in patients with hormone receptor positive, HER2 negative locally advanced or metastatic breast cancer treated with palbociclib and an aromatase inhibitor or palbociclib and fulvestrant. Trials. 2023 May 17;24(1):338. doi: 10.1186/s13063-023-07306-z. PMID: 37198674; PMCID: PMC10193608
14. Nadia Harbeck, Peter A. Fasching, Rachel Wuerstlein, Tom Degenhardt, Diana Lüftner, Ronald E. Kates, Johannes Schumacher, Philip Raeth, Oliver Hoffmann, Ralf Lorenz, Thomas Decker, Mattea Reinisch, Thomas Göhler, Peter Staib, Oleg Gluz, Timo Schinkoethe, Marcus Schmidt. CANKADO PRO-React eHealth support in patients with HR+ HER2- metastatic breast cancer receiving palbociclib and endocrine therapy and the affect on time to deterioration of quality of life: Primary outcome analysis of the multicenter randomized PreCycle trial.
15. Gradishar WJ, Moran MS, Abraham J, Aft R, Agnese D, Allison KH, Anderson B, Burstein HJ, Chew H, Dang C, Elias AD, Giordano SH, Goetz MP, Goldstein LJ, Hurvitz SA, Isakoff SJ, Jankowitz RC, Javid SH, Krishnamurthy J, Leitch M, Lyons J, Mortimer J, Patel SA, Pierce LJ, Rosenberger LH, Rugo HS, Sitapati A, Smith KL, Smith ML, Soliman H, Stringer-Reasor EM, Telli ML, Ward JH, Wisinski KB, Young JS, Burns J, Kumar R. Breast Cancer, Version 3.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Jun;20(6):691-722. doi: 10.6004/jnccn.2022.0030. PMID: 35714673.
16. Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, Lluch A, Staroslawska E, de la Haba-Rodriguez J, Im SA, Pedrini JL, Poirier B, Morandi P, Semiglazov V, Srimuninnimit V, Bianchi G, Szado T, Ratnayake J, Ross G, Valagussa P. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 Jan;13(1):25-32. doi: 10.1016/S1470-2045(11)70336-9. Epub 2011 Dec 6. PMID: 22153890.
17. van Ramshorst MS, van der Voort A, van Werkhoven ED, Mandjes IA, Kemper I, Dezentjé VO, Oving IM, Honkoop AH, Tick LW, van de Wouw AJ, Mandigers CM, van Warmerdam LJ, Wesseling J, Vrancken Peeters MT, Linn SC, Sonke GS; Dutch Breast Cancer Research Group (BOOG). Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 Dec;19(12):1630-1640. doi: 10.1016/S1470-2045(18)30570-9. Epub 2018 Nov 6. PMID: 30413379.
18. Fernandez-Martinez A, Pascual T, Singh B, Nuciforo P, Rashid NU, Ballman KV, Campbell JD, Hoadley KA, Spears PA, Pare L, Brasó-Maristany F, Chic N, Krop I, Partridge A, Cortés J, Llombart-Cussac A, Prat A, Perou CM, Carey LA. Prognostic and Predictive Value of Immune-Related Gene Expression Signatures vs Tumor-Infiltrating Lymphocytes in Early-Stage ERBB2/HER2-Positive Breast Cancer: A Correlative Analysis of the CALGB 40601 and PAMELA Trials. JAMA Oncol. 2023 Apr 1;9(4):490-499. doi: 10.1001/jamaoncol.2022.6288. PMID: 36602784; PMCID: PMC9857319.
19. Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, Boriani G, Cardinale D, Cordoba R, Cosyns B, Cutter DJ, de Azambuja E, de Boer RA, Dent SF, Farmakis D, Gevaert SA, Gorog DA, Herrmann J, Lenihan D, Moslehi J, Moura B, Salinger SS, Stephens R, Suter TM, Szmit S, Tamargo J, Thavendiranathan P, Tocchetti CG, van der Meer P, van der Pal HJH; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022 Nov 1;43(41):4229-4361. doi: 10.1093/eurheartj/ehac244. Erratum in: Eur Heart J. 2023 May 7;44(18):1621. PMID: 36017568.
20. von Minckwitz G, Huang CS, Mano MS, Loibl S, Mamounas EP, Untch M, Wolmark N, Rastogi P, Schneeweiss A, Redondo A, Fischer HH, Jacot W, Conlin AK, Arce-Salinas C, Wapnir IL, Jackisch C, DiGiovanna MP, Fasching PA, Crown JP, Wülfing P, Shao Z, Rota Caremoli E, Wu H, Lam LH, Tesarowski D, Smitt M, Douthwaite H, Singel SM, Geyer CE Jr; KATHERINE Investigators. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 Feb 14;380(7):617-628. doi: 10.1056/NEJMoa1814017. Epub 2018 Dec 5. PMID: 30516102.
21. Schmid P, Cortes J, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Foukakis T, Fasching PA, Cardoso F, Untch M, Jia L, Karantza V, Zhao J, Aktan G, Dent R, O’Shaughnessy J; KEYNOTE-522 Investigators. Pembrolizumab for Early Triple-Negative Breast Cancer. N Engl J Med. 2020 Feb 27;382(9):810-821. doi: 10.1056/NEJMoa1910549. PMID: 32101663.
22. Schmid P, Cortes J, Dent R, Pusztai L, McArthur H, Kümmel S, Bergh J, Denkert C, Park YH, Hui R, Harbeck N, Takahashi M, Untch M, Fasching PA, Cardoso F, Andersen J, Patt D, Danso M, Ferreira M, Mouret-Reynier MA, Im SA, Ahn JH, Gion M, Baron-Hay S, Boileau JF, Ding Y, Tryfonidis K, Aktan G, Karantza V, O’Shaughnessy J; KEYNOTE-522 Investigators. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N Engl J Med. 2022 Feb 10;386(6):556-567. doi: 10.1056/NEJMoa2112651. PMID: 35139274.
23. Loibl S, Schneeweiss A, Huober JB, et al: Durvalumab improves long-term outcome in TNBC: Results from the phase II randomized GeparNuevo study investigating neoadjuvant durvalumab in addition to an anthracycline/taxane based neoadjuvant chemotherapy in early triple-negative breast cancer. 2021 ASCO Annual Meeting. Abstract 506. Presented June 7, 2021.
24. Morad G, Helmink BA, Sharma P, Wargo JA. Hallmarks of response, resistance, and toxicity to immune checkpoint blockade. Cell. 2021 Oct 14;184(21):5309-5337. doi: 10.1016/j.cell.2021.09.020. Epub 2021 Oct 7. Erratum in: Cell. 2022 Feb 3;185(3):576. PMID: 34624224; PMCID: PMC8767569.
25. Haanen J, Obeid M, Spain L, Carbonnel F, Wang Y, Robert C, Lyon AR, Wick W, Kostine M, Peters S, Jordan K, Larkin J; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Dec;33(12):1217-1238. doi: 10.1016/j.annonc.2022.10.001. Epub 2022 Oct 18. PMID: 36270461.
26. Thompson JA, Schneider BJ, Brahmer J, Achufusi A, Armand P, Berkenstock MK, Bhatia S, Budde LE, Chokshi S, Davies M, Elshoury A, Gesthalter Y, Hegde A, Jain M, Kaffenberger BH, Lechner MG, Li T, Marr A, McGettigan S, McPherson J, Medina T, Mohindra NA, Olszanski AJ, Oluwole O, Patel SP, Patil P, Reddy S, Ryder M, Santomasso B, Shofer S, Sosman JA, Wang Y, Zaha VG, Lyons M, Dwyer M, Hang L. Management of Immunotherapy-Related Toxicities, Version 1.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Apr;20(4):387-405. doi: 10.6004/jnccn.2022.0020. PMID: 35390769.
27. Goetz MP, Toi M, Campone M, Sohn J, Paluch-Shimon S, Huober J, Park IH, Trédan O, Chen SC, Manso L, Freedman OC, Garnica Jaliffe G, Forrester T, Frenzel M, Barriga S, Smith IC, Bourayou N, Di Leo A. MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol. 2017 Nov 10;35(32):3638-3646. doi: 10.1200/JCO.2017.75.6155. Epub 2017 Oct 2. PMID: 28968163.
28. Finn RS, Martin M, Rugo HS, Jones S, Im SA, Gelmon K, Harbeck N, Lipatov ON, Walshe JM, Moulder S, Gauthier E, Lu DR, Randolph S, Diéras V, Slamon DJ. Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med. 2016 Nov 17;375(20):1925-1936. doi: 10.1056/NEJMoa1607303. PMID: 27959613.
29. Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Paluch-Shimon S, Campone M, Petrakova K, Blackwell KL, Winer EP, Janni W, Verma S, Conte P, Arteaga CL, Cameron DA, Mondal S, Su F, Miller M, Elmeliegy M, Germa C, O’Shaughnessy J. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018 Jul 1;29(7):1541-1547. doi: 10.1093/annonc/mdy155. Erratum in: Ann Oncol. 2019 Nov 1;30(11):1842. PMID: 29718092.
30. Hortobagyi GN, Stemmer SM, Burris HA, Yap YS, Sonke GS, Hart L, Campone M, Petrakova K, Winer EP, Janni W, Conte P, Cameron DA, André F, Arteaga CL, Zarate JP, Chakravartty A, Taran T, Le Gac F, Serra P, O’Shaughnessy J. Overall Survival with Ribociclib plus Letrozole in Advanced Breast Cancer. N Engl J Med. 2022 Mar 10;386(10):942-950. doi: 10.1056/NEJMoa2114663. PMID: 35263519.
31. Thill M, Schmidt M. Management of adverse events during cyclin-dependent kinase 4/6 (CDK4/6) inhibitor-based treatment in breast cancer. Ther Adv Med Oncol. 2018 Sep 3;10:1758835918793326. doi: 10.1177/1758835918793326. Erratum in: Ther Adv Med Oncol. 2018 Dec 03;10:1758835918810116. PMID: 30202447; PMCID: PMC6122233.
32. van Ommen-Nijhof A, Konings IR, van Zeijl CJJ, Uyl-de Groot CA, van der Noort V, Jager A, Sonke GS; SONIA study steering committee. Selecting the optimal position of CDK4/6 inhibitors in hormone receptor-positive advanced breast cancer – the SONIA study: study protocol for a randomized controlled trial. BMC Cancer. 2018 Nov 20;18(1):1146. doi: 10.1186/s12885-018-4978-1. PMID: 30458732; PMCID: PMC6247672.
33. Hafeez U, Parakh S, Gan HK, Scott AM. Antibody-Drug Conjugates for Cancer Therapy. Molecules. 2020 Oct 16;25(20):4764. doi: 10.3390/molecules25204764. PMID: 33081383; PMCID: PMC7587605.
34. Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, Pegram M, Oh DY, Diéras V, Guardino E, Fang L, Lu MW, Olsen S, Blackwell K; EMILIA Study Group. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012 Nov 8;367(19):1783-91. doi: 10.1056/NEJMoa1209124. Epub 2012 Oct 1. Erratum in: N Engl J Med. 2013 Jun 20;368(25):2442. PMID: 23020162; PMCID: PMC5125250.
35. Modi S, Saura C, Yamashita T, Park YH, Kim SB, Tamura K, Andre F, Iwata H, Ito Y, Tsurutani J, Sohn J, Denduluri N, Perrin C, Aogi K, Tokunaga E, Im SA, Lee KS, Hurvitz SA, Cortes J, Lee C, Chen S, Zhang L, Shahidi J, Yver A, Krop I; DESTINY-Breast01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020 Feb 13;382(7):610-621. doi: 10.1056/NEJMoa1914510. Epub 2019 Dec 11. PMID: 31825192; PMCID: PMC7458671.
36. Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveira M, Brufsky A, Sardesai SD, Kalinsky K, Zelnak AB, Weaver R, Traina T, Dalenc F, Aftimos P, Lynce F, Diab S, Cortés J, O’Shaughnessy J, Diéras V, Ferrario C, Schmid P, Carey LA, Gianni L, Piccart MJ, Loibl S, Goldenberg DM, Hong Q, Olivo MS, Itri LM, Rugo HS; ASCENT Clinical Trial Investigators. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541. doi: 10.1056/NEJMoa2028485. PMID: 33882206.
37. Diéras V, Miles D, Verma S, Pegram M, Welslau M, Baselga J, Krop IE, Blackwell K, Hoersch S, Xu J, Green M, Gianni L. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol. 2017 Jun;18(6):732-742. doi: 10.1016/S1470-2045(17)30312-1. Epub 2017 May 16. Erratum in: Lancet Oncol. 2017 Aug;18(8):e433. Erratum in: Lancet Oncol. 2018 Dec;19(12):e667. PMID: 28526536; PMCID: PMC5531181.
38. Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, Tsurutani J, Ueno NT, Prat A, Chae YS, Lee KS, Niikura N, Park YH, Xu B, Wang X, Gil-Gil M, Li W, Pierga JY, Im SA, Moore HCF, Rugo HS, Yerushalmi R, Zagouri F, Gombos A, Kim SB, Liu Q, Luo T, Saura C, Schmid P, Sun T, Gambhire D, Yung L, Wang Y, Singh J, Vitazka P, Meinhardt G, Harbeck N, Cameron DA; DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20. doi: 10.1056/NEJMoa2203690. Epub 2022 Jun 5. PMID: 35665782.
39. Rugo HS, Bianchini G, Cortes J, Henning JW, Untch M. Optimizing treatment management of trastuzumab deruxtecan in clinical practice of breast cancer. ESMO Open. 2022 Aug;7(4):100553. doi: 10.1016/j.esmoop.2022.100553. Epub 2022 Aug 11. PMID: 35964548; PMCID: PMC9375150.
Therapeutische Umschau
- Vol. 80
- Ausgabe 8
- Oktober 2023