- Prämenopausale Osteoporose: Ätiopathologie, Diagnostik und Behandlung
Einleitung
Die Epidemiologie der Osteoporose und die Frakturrate bei prämenopausalen Frauen sind undurchsichtig. Die Prävalenz der Osteoporose bei prämenopausalen Frauen ist sehr variabel und hängt von der untersuchten Population, der Definition der Osteoporose und dem jeweiligen Referenzzentrum ab (1). In der Regel sind Frakturen und eine niedrige Knochenmineraldichte (KMD) bei prämenopausalen Frauen deutlich seltener und werden auf einen unvollständigen Aufbau der maximalen Knochenmasse oder das Vorhandensein sekundärer Ursachen eines Knochenverlustes zurückgeführt (2). Die Beziehung zwischen der KMD und dem Frakturrisiko unterscheidet sich zwischen prämenopausalen und postmenopausalen Frauen. Dies stellt eine Herausforderung für die Diagnose und Behandlung der Osteoporose bei prämenopausalen oder perimenopausalen Frauen dar, was durch den fehlenden Konsens zwischen den Osteoporoseleitlinien deutlich wird. Eine prämenopausale Frau mit einer Fragilitätsfraktur in der Vergangenheit hat ein 35 % bis 75 % höheres Risiko, in der Postmenopause eine Fraktur zu erleiden als eine prämenopausale Frau ohne vorherige Fraktur (3). Daher können eine frühzeitige Diagnose und Behandlung von Vorteil sein. In dieser Übersichtsarbeit sollen die diagnostischen Kriterien, die Pathophysiologie, die diagnostische Abklärung und die Behandlung der Osteoporose bei prämenopausalen Frauen diskutiert werden.
Definitionen
Die meisten Leitlinien stimmen darin überein, dass die Diagnose der Osteoporose bei prämenopausalen Frauen nicht allein auf der Grundlage der KMD gestellt werden kann. Eine prämenopausale Osteoporose liegt vor beim Vorhandensein von klinisch relevanten Fragilitätsfrakturen, z. B. Femurfrakturen oder Wirbelkörperfrakturen oder bei anderen Fragilitätsfrakturen in Kombination mit einer niedrigen Knochenmasse. Die Internationale Gesellschaft für klinische Densitometrie (ISCD) empfiehlt die Verwendung von KMD-Z-Scores (Vergleich mit altersentsprechenden Normen) zur Klassifizierung der KMD bei prämenopausalen Frauen. Die ISCD schlägt vor, dass ein KMD-Z-Score > –2.0 als normale KMD und ein BMD-Z-Score ≤ –2.0 als «unterhalb des erwarteten Altersbereichs» eingestuft werden sollten. Die ISCD empfiehlt ausserdem, T-Werte nicht für die Diagnose von Osteopenie oder Osteoporose bei prämenopausalen Frauen zu verwenden bzw. die Diagnose «Osteoporose» bei prämenopausalen Frauen nur im Beisein von Fragilitätsfrakturen oder sekundären Ursachen der Osteoporose zu stellen (4). Die Internationale Osteoporose Stiftung (IOF) empfiehlt die Verwendung des Z-Scores bei Kindern, Jugendlichen und Erwachsenen unter 20 Jahren und bei Personen über 20 Jahren im Falle einer verzögerten Pubertät. Bei Personen ab 20 Jahren empfiehlt die IOF, einen T-Score < –2,5 als Diagnosekriterium für die Osteoporose zu verwenden. Die IOF empfiehlt, die Diagnosekriterien vor allem bei prämenopausalen Frauen mit Fragilitätsfrakturen oder sekundären Ursachen für eine Osteoporose einzusetzen, schliesst aber nicht aus, die Diagnose allein auf der Grundlage der KMD zu stellen (5). In der klinischen Praxis sollte die KMD nur bei prämenopausalen Frauen mit klinisch bedeutsamen Frakturen oder sekundären Ursachen für eine geringe Knochenmasse bestimmt werden.
Klinische Relevanz
Die Diagnose der Osteoporose bei prämenopausalen Frauen sollte auf dem Vorhandensein von klinisch relevanten Fragilitätsfrakturen in Kombination mit einer niedrigen KMD gestellt werden.
Ätiopathologie
Eine niedrige Knochenmasse bei Frauen in der Prämenopause steht in Zusammenhang mit einem unzureichenden Aufbau der maximalen Knochenmasse (peak bone mass), der durch einen zusätzlichen Knochenverlust aufgrund einer Erkrankung, die zum Knochenverlust prädisponiert, verstärkt wird.
Unzureichende maximale Knochenmasse
Der Knochenaufbau findet in der Kindheit und Jugend statt und erreicht seinen Höhepunkt im Alter von 20 Jahren, wobei die Zuwächse je nach Skelettlage bis zum Alter von 30 Jahren geringer ausfallen (6). Das bedeutet, dass Frauen, die jünger als 30 Jahre sind, möglicherweise noch nicht an allen Skelettlagen die maximale Knochenmasse erreicht haben, und dies sollte bei der Interpretation von KMD-Messungen berücksichtigt werden. Viele Faktoren beeinflussen physiologisch das Knochenwachstum, einschliesslich genetischer Variationen in der Mikroarchitektur der Knochen, des Körperhabitus und der sexuellen Entwicklung. In der Folge beeinflussen Lebensstil und Umweltfaktoren den Aufbau der Knochenmasse.
Erblichkeitsanalysen und genomweite Assoziationsstudien (GWAS) haben die Bedeutung der genetischen Prädisposition zur Pathogenese der Osteoporose hervorgehoben (7, 8). Durch grosse Einzel-GWAS und Metaanalysen solcher GWAS wurden über 500 genetische Loci identifiziert worden, die das Risiko für Osteoporose regulieren (8, 9). Die meisten dieser häufig vorkommenden Varianten oder Loci erklären jedoch zusammengenommen weniger als 20 % der Varianz der KMD (10). Interessanterweise sind seltene genetische Varianten mit grosser Wirkung, einschliesslich in Genen, die bekanntermassen monogene Formen der Osteoporose verursachen, auch mit niedriger KMD und Frakturrisiko assoziiert (11). Zu letzteren gehören Erkrankungen wie die Osteogenesis imperfecta, das Marfan-Syndrom und das Ehlers-Danlos-Syndrom, die in unterschiedlichen Schweregraden auftreten können und als mögliche Ursachen für Osteoporose bei jungen Erwachsenen betrachtet werden können (12). Bestimmte familiäre Erkrankungen wie die Zöliakie und idiopathische Hyperkalziurie können ebenfalls dazu beitragen, dass die maximale Knochenmasse nicht erreicht wird (2).
Sexualsteroide spielen eine grundlegende Rolle bei der Entwicklung der Knochenmasse. Dies wird durch die negativen Auswirkungen einer verzögerten Menarche oder einer Amenorrhö auf die Knochengesundheit belegt (13). Östrogene zum Beispiel verringern die Osteoklastenaktivität, während sie die Osteoblastenaktivierung bewirken (13). Ein prämenopausaler Östrogenmangel ist daher eine der Hauptursachen für eine niedrige Knochenmasse. Östrogenarme Zustände können entweder durch eine verminderte Gonadotropin-Stimulation der Ovarien (zentraler Hypogonadismus) oder durch vorzeitige Ovarialinsuffizienz mit daraus resultierender hypergonadotroper Stimulation (primärer Hypogonadismus) verursacht werden. Weitere Beispiele für zentralen und primären Hypogonadismus sind in Tab. 1 aufgeführt. Hormonelle Empfängnisverhütung in der Jugend wurde in der Vergangenheit als ein kontroverses Thema bezüglich der Knochengesundheit angesehen. Eine kürzlich durchgeführte retrospektive Fall-Kontroll-Studie mit 12 970 Frauen vor der Menopause zeigte jedoch eine signifikante Abnahme des Frakturrisikos bei der Verwendung von kombinierten oralen Kontrazeptiva (14). Das Ausmass der Risikoreduktion war grösser mit zunehmender Dauer der Einnahme kombinierter oraler Kontrazeptiva (14).

Weitere Ursachen für eine suboptimale maximale Knochenmasse können ein in der Vergangenheit liegender Ernährungsmangel sowie eine eingeschränkte körperliche Aktivität in der Kindheit und im jungen Erwachsenenalter sein. Zu den Ernährungsdefiziten gehören eine niedrige Kalziumzufuhr und eine suboptimale Vitamin-D-Supplementierung; sie stehen häufig im Zusammenhang mit malabsorptiven Störungen, die zu einer geringeren Knochenmasse beitragen. Ein übermässiger Alkoholkonsum und Tabakkonsum werden ebenfalls mit einer Beeinträchtigung der Knochengesundheit in Verbindung gebracht. Körperliche Aktivität und Muskelkraft korrelieren signifikant mit verbesserten Knocheneigenschaften, insbesondere bei jüngeren Erwachsenen. Körperlich aktive Frauen entwickeln eine höhere KMD und einen höheren Trabekelgehalt als inaktive prämenopausale Frauen (15).
Anhaltender Knochenverlust
Die Identifizierung einer niedrigen Knochenmasse oder einer Fragilitätsfraktur bei jüngeren Frauen erfordert eine gründliche Untersuchung und Evaluation, da die meisten dieser Fälle auf sekundäre Ursachen, zugrunde liegende Medikamente oder Erkrankungen, die zum Knochenschwund beitragen, zurückzuführen sind (2, 16).
Verschiedene Endokrinopathien werden mit einem vorzeitigen Knochenverlust in Verbindung gebracht und sind oft reversibel, wie z. B. ein niedriger Östrogenspiegel. Eine Hyperthyreose beschleunigt den Knochenumsatz aufgrund eines hypermetabolischen Zustands. Ein Cushing-Syndrom, gekennzeichnet durch einen pathologischen Überschuss an adrenokortikotropem Hormon und/oder Cortisol aus der Hypophyse bzw. Nebenniere, beeinträchtigt die Knochengesundheit erheblich. Ein primärer Hyperparathyreoidismus aufgrund eines Nebenschilddrüsenadenoms oder einer Nebenschilddrüsenhyperplasie stimuliert eine übermässige Knochenresorption. Die idiopathische Hyperkalziurie ist eine zunehmend anerkannte Ursache für niedrige KMD bei jungen Erwachsenen. Diese Erkrankung ist durch eine übermässige Kalziumausscheidung im Urin gekennzeichnet, ohne dass eine erkennbare Ursache, wie z. B. ein primärer Hyperparathyreoidismus, identifiziert werden kann. Kalziumverluste im Urin führen zu einer negativen Kalziumbilanz, die wiederum das Risiko für Knochenverlust und -frakturen erhöht.
Malabsorptive Störungen wie Zöliakie sind mit einem erhöhten Frakturrisiko und einer abnormalen Knochenmikroarchitektur assoziiert durch eine verringerte Aufnahme von essenziellen Nährstoffen wie Vitamin D und Kalzium. Andere malabsorptive Störungen umfassen bariatrische Operationen, zystische Fibrose und entzündliche Darmerkrankungen. Die beiden letztgenannten Erkrankungen begünstigen den Knochenabbau zusätzlich durch die Behandlung mit Steroiden und die Kalzium- und Vitamin-D-Malabsorption. Eine umfassende Liste von zusätzlichen Ursachen, die zum Knochenverlust beitragen, ist in der Tab. 2 aufgeführt.
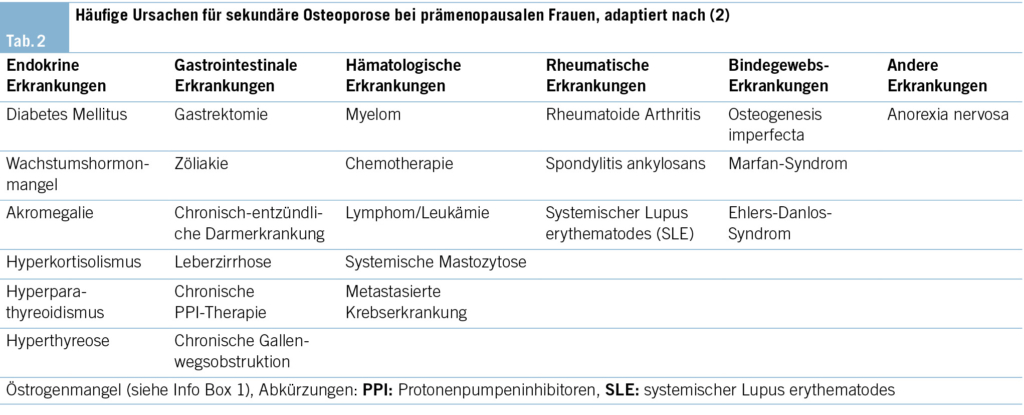
Bestimmte Medikamente, die in der Tab. 3 aufgeführt sind, werden durch verschiedene Mechanismen mit einem Knochenverlust in Verbindung gebracht (17).
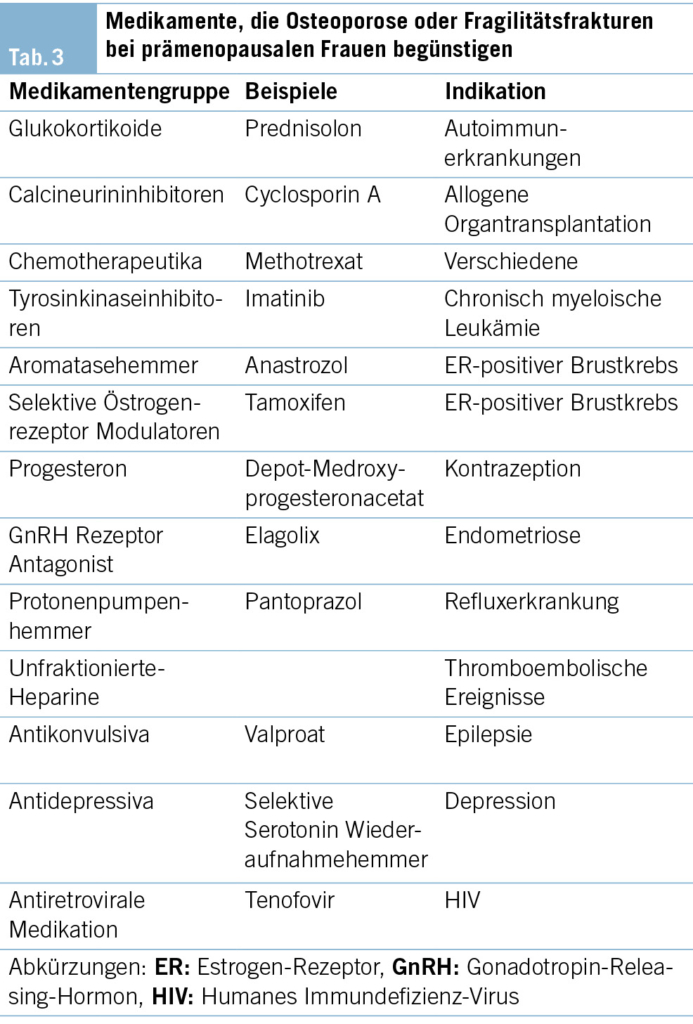
Glukokortikoide beispielsweise verstärken den Knochenabbau durch verminderte Osteoblastenreifung und beeinträchtigte Osteoklastenapoptose (18). Prämenopausale Frauen, die wegen rheumatologischer Erkrankungen, Autoimmunerkrankungen oder transplantationsbedingter Immunsuppression mit Glukokortikoiden behandelt werden, haben ein erhöhtes Risiko für eine erniedrigte KMD und/oder Fragilitätsfrakturen, die als Glukokortikoid-induzierte Osteoporose bezeichnet wird. Eine weitere Kategorie von Medikamenten mit schädlichen Auswirkungen auf die Knochen wird bei Frauen im Rahmen einer Brustkrebserkrankung eingesetzt. Adjuvante Therapien, einschliesslich Chemotherapie und Gonadotropin-Releasing-Hormon(GnRH)-Analoga, können eine sekundäre Amenorrhö und eine vorzeitige Menopause verursachen. Ausserdem Tamoxifen, ein selektiver Östrogen-Rezeptor Modulator, der bei postmenopausalen Frauen eine schützende Rolle für die Knochen spielt, wirkt bei prämenopausalen Frauen als Antiöstrogen und wurde mit einem um 75 % erhöhten Frakturrisiko bei prämenopausalen Patientinnen mit Mammakarzinom im Vergleich zu gesunden Kontrollpersonen assoziiert (19). Schliesslich wurde im Jahr 2018 Elagolix, ein oral verabreichter nicht peptidischer GnRH-Antagonist, für die Behandlung von Endometriose-assoziierten Schmerzen zugelassen. Bei einer Verabreichung von 6 bis maximal 12 Monaten war dieses Medikament mit einem KMD-Verlust verbunden, insbesondere bei höheren Dosierungen (20).
Besondere Konditionen
Eine niedrige KMD ohne fassbare Ursache für den Knochenverlust wird als idiopathisch niedrige Knochenmasse definiert. In ähnlicher Weise wird von einer idiopathischen Osteoporose bei einer prämenopausalen Frau mit einer Vorgeschichte skelettaler Fragilität bzw. ohne sekundäre Ursache für eine Osteoporose gesprochen. Die genauen Mechanismen, die dieser Krankheit zugrunde liegen, sind noch nicht vollständig geklärt. Zu den vorgeschlagenen Mechanismen gehören gestörter Knochenumbau, osteoblastische Dysfunktion und Störungen der Knochenmikroarchitektur (21).
Schliesslich ist die normale Laktation mit einem vorübergehenden Knochenverlust verbunden, der auf die physiologische Amenorrhö und der Sekretion von Parathormon (PTH)-verwandtem Protein (PTHrP) durch die laktierende Brustdrüse zurückzuführen ist (22). Das Ausmass des Knochenverlustes korreliert mit der Dauer der Laktation (und der anschliessenden Amenorrhö) und kehrt sich mit dem Abstillen weitgehend um (23). Die schwangerschafts- und laktationsassoziierte Osteoporose (PLAO) ist ein Begriff für eine früh einsetzende Osteoporose mit Fragilitätsfrakturen, die im Zusammenhang mit den Veränderungen der Knochenmasse und des Stoffwechsels während der Schwangerschaft und Stillzeit auftreten. In einigen Fällen, die als PLAO identifiziert werden, kommt es zu einer Wirbelkörperfraktur. Symptome treten in der Regel während der Laktation und nicht während der Schwangerschaft auf. Sehr niedrige KMD mittels Dual Energy X-ray Absorptiometry (DXA) und volumetrische/strukturelle Knochendefizite sind dokumentiert worden (24). Die genaue Ursache dieser seltenen Störung ist nicht vollständig geklärt, insbesondere bleibt unklar, ob sie bei bestimmten Frauen ausschliesslich durch die Schwangerschaft selbst verursacht wird und/oder ob eine Schwangerschaft einen Status vorheriger Knochenfragilität aufzeigt. In einer grossen PLAO-Genetikstudie (n = 42) wurden mittels Gen Panel-Screening in 50 % der Fälle heterozygote Varianten, die als relevant für die Erkrankung angesehen werden, dokumentiert (25). In 26 % der Frauen wurden relevante Varianten in LRP5 oder WNT1, die mit dem für die Knochenbildung entscheidenden WNT-Signalweg zusammenhängen, dokumentiert (25). Die Gruppe mit relevanten genetischen Varianten wies einen schwereren Verlauf mit einer höheren Anzahl von Frakturen auf (25). Eine Studie bei Frauen mit PLAO, bei der Knochenbiopsien 12 Monate nach der Geburt durchgeführt wurden, zielte darauf ab, den Ausgangszustand des Knochenumbaus zu beurteilen (26). Transiliakale Knochenbiopsien dieser Frauen zeigten einen geringen Knochenumsatz im Vergleich zu Patientinnen mit idiopathischer Osteoporose, die an sich schon ein Zustand geringer Knochenbildung ist (26). Diese Befunde wurden durch niedrigere Knochenumbaumarker im Serum bestätigt und deuten auf die Möglichkeit eines zugrunde liegenden Defekts in der Osteoblastenfunktion hin (26).
Diagnostik/weitere Abklärung bei prämenopausalen Frauen mit Fragilitätsfrakturen und/oder sehr niedriger Knochenmasse
Wie bereits erwähnt, ist es wichtig, mögliche sekundäre Ursachen für geringe Knochenmasse/Fragilitätsfrakturen zu ermitteln, da einige korrigiert oder behandelt werden können. Darüber hinaus können einige Medikamente auf andere Substanzen ohne negative Auswirkungen auf den Knochenstoffwechsel umgestellt werden.
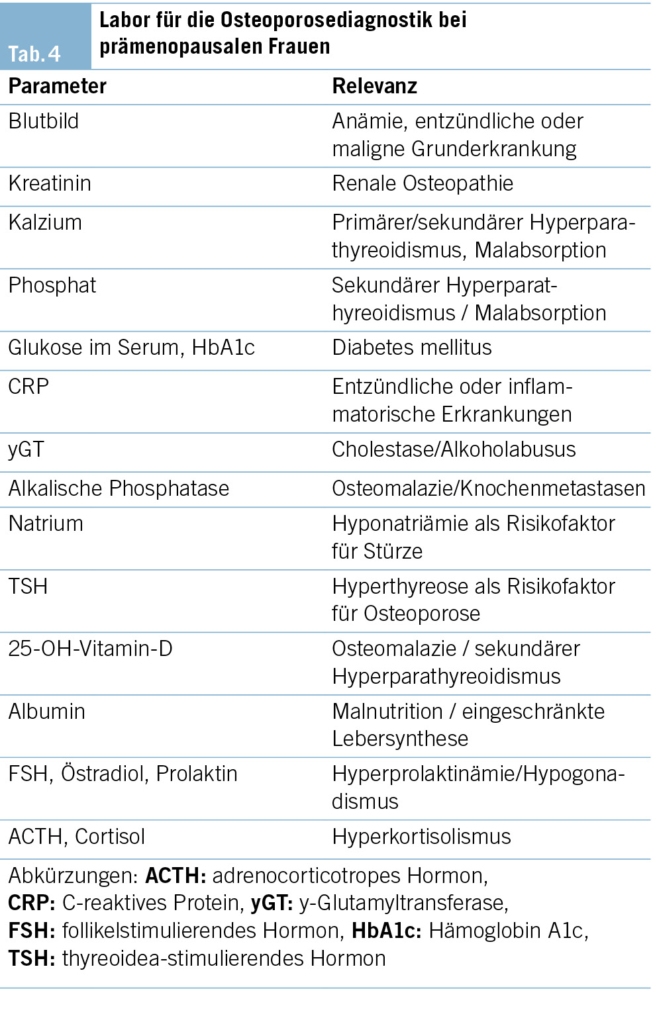
Die Untersuchung sollte eine vollständige Anamnese umfassen mit besonderem Fokus auf Frakturen, Nierensteinen, Oligomenorrhoe oder anderen Anzeichen eines Östrogenmangels, Schwangerschaften und Stillzeit, menstrualen Zyklus, Ernährungsgewohnheiten, Bewegung und Körpergewicht im Laufe der Zeit (2, 27). Ausserdem sind Informationen über die Familienanamnese in Bezug auf Frakturen und andere Erkrankungen des Knochenmetabolismus wichtig (27). Eine eingehende körperliche Untersuchung kann helfen, Anzeichen, wie zum Beispiel blaue Skleren oder schlechtes Gebiss (Osteogenesis imperfecta), Akanthose, Striae, zentrale Adipositas (Cushing-Syndrom), Schmetterlingsausschlag oder Gelenkschwellungen (rheumatologische Erkrankungen), zu erkennen (2). Die biochemische Untersuchung sollte auf Krankheiten, die mit einer erniedrigten Knochenmasse oder Fragilitätsfrakturen einhergehen, fokussieren (Tab. 4). Die Bildgebung umfasst die Untersuchung der KMD mittels DXA und bei Verdacht auf Wirbelkörperfrakturen Röntgen der Wirbelsäule oder Beurteilung von Wirbelkörperfrakturen mittels DXA (VFA). Anspruchsvollere Bildgebungsmodalitäten, wie zum Beispiel die hochauflösende periphere quantitative Computertomographie (HR-pQCT), können die Mikroarchitektur des Knochens beurteilen, was auch bei der Identifizierung von Patientinnen mit hohem Frakturrisiko helfen kann (28). Ein Gentest sollte in Erwägung gezogen werden bei Patientinnen mit Kleinwuchs, wiederkehrenden Frakturen, multiplen Wirbelkörperfrakturen, Knochendeformitäten, Frakturen an ungewöhnlichen Stellen, früh manifestierter Osteoporose, sehr niedriger KMD und einer Familienanamnese, die auf eine monogenetische Form der Osteoporose hinweist (12).
Klinische Relevanz
Bei prämenopausalen Frauen mit erniedrigter Knochenmasse/Fragilitätsfrakturen sollte eine Untersuchung auf sekundäre Ursachen, die in dieser Altersgruppe überwiegend zu skelettaler Fragilität beitragen, initiiert werden.
Management
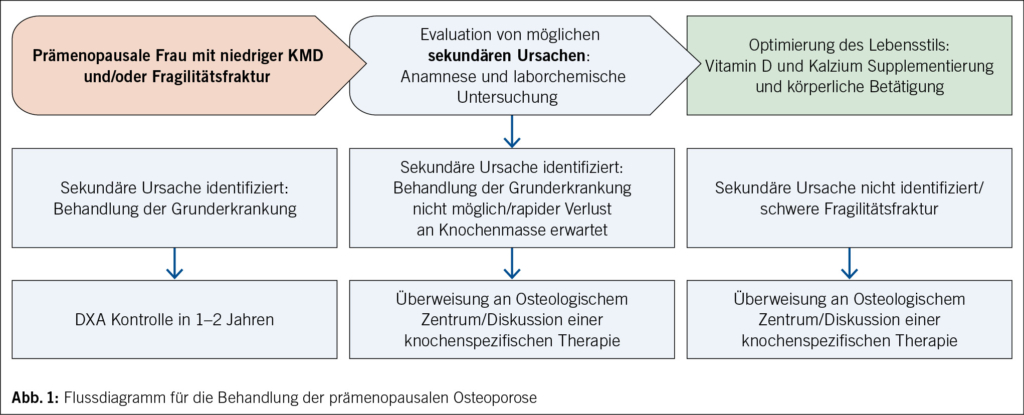
Die Behandlung der prämenopausalen Osteoporose ist herausfordernd, da es an soliden Erkenntnissen darüber fehlt, wie das zukünftige Frakturrisiko am besten vorhergesagt und gesenkt werden kann. Die derzeit verfügbare Osteoporoseforschung und die Strategien zur Behandlung der Osteoporose konzentrieren sich auf postmenopausale Frauen und ältere Männer. Ein Flussdiagramm für das Gesamtmanagement von prämenopausalen Frauen mit Osteoporose und Fragilitätsfrakturen ist in Abb. 1 dargestellt.
Nicht pharmakologische Ansätze
Eine 2-jährige randomisierte kontrollierte Studie, in die 470 prämenopausale Frauen im Alter von 25 bis 44 Jahren eingeschlossen wurden, zeigte, dass die Aufklärung junger Frauen über klassische Osteoporoserisikofaktoren mit einer langfristigen Verbesserung bezüglich Osteoporosepräventionsverhalten verbunden war (29). Dies ist von besonderer Bedeutung, wenn man bedenkt, dass eine Untersuchung über Wissen, Überzeugungen und Praktiken in Bezug auf Osteoporose bei jungen Erwachsenen ergab, dass sie sich der Krankheit nicht bewusst waren (30).
Es gibt einige Evidenz für die positiven Auswirkungen von körperlicher Aktivität bei Frauen vor der Menopause. 40 junge Frauen im Alter von 30 bis 45 Jahren mit kürzlich diagnostizierter Osteoporose wurden in 4 Gruppen aufgeteilt über einen Zeitraum von 10 Wochen: Trainingsgruppe (Aerobic-Widerstand) plus Milchkonsum (500 ml täglich), nur Milchkonsum, nur Training und Kontrollen. Diese Studie zeigte, dass signifikante Unterschiede der KMD an der Lendenwirbelsäule und am Femur gab, wobei die Gruppe Training plus Milchkonsum höhere KMD Werten aufwies (31). Eine randomisierte kontrollierte Studie, an der 206 prämenopausale Frauen teilnahmen, bei denen die Diagnose Mammakarzinom vor dem 55. Lebensjahr gestellt wurde, zeigte, dass eine Kombination aus Widerstandstraining und aerobem Training innerhalb von 2 Jahren nach Erhalt einer adjuvanten Chemotherapie den Knochenverlust an der Lendenwirbelsäule während einer 12-monatigen Nachbeobachtungszeit verhinderte (32). Die Patientinnen sollten jedoch darauf hingewiesen werden, dass sie übermässige körperliche Betätigung vermeiden sollten, da diese den Knochenabbau durch Gewichtsverlust oder eine funktionelle hypothalamische Amenorrhö weiter fördern kann. Obwohl es dringend empfohlen wird, den Tabak- und Alkoholkonsum zu beenden, haben keine Studien bis dato die Auswirkungen dieser Massnahme auf KMD/Frakturrisiko bei prämenopausalen Frauen nachgewiesen.
Hinsichtlich der Supplementierung mit Kalzium und Vitamin D liegen keine Studien über eine Fraktursenkung vor, es wurde allerdings in einigen kleineren Studien ein Anstieg der KMD beobachtet (33, 34). Die Supplementierung umfasst eine angemessene tägliche Kalziumzufuhr von 1000 bis 1200 mg, in geteilten Dosen, vorzugsweise über die Ernährung, und eine Vitamin-D-Supplementierung zur Erreichung des Zielwerts für den 25-OH-Spiegel > 30 ng/ml bzw. einen 25-OH-Spiegel, der eine Hypokalziurie und einen sekundären Hyperparathyreoidismus verhindert. Diese Empfehlung sind von Leitlinien der postmenopausalen Osteoporose übernommen (35).
Die Behandlung von Grunderkrankungen oder sekundären Faktoren scheint sich darüber hinaus positiv auf die Knochen auszuwirken. So wurde zum Beispiel ein Anstieg der KMD mit einer Diät bei Zöliakie, Anti-TNF-Behandlung bei chronischen inflammatorischen Darmerkrankungen, Östrogenen bei Amenorrhö, Operationen bei primärem Hyperparathyreoidismus und Morbus Cushing, Behandlung von Hyperthyreose und Unterernährung dokumentiert (1).
Pharmakologische Ansätze
Wenn eine Behandlung der zugrunde liegenden Erkrankung nicht möglich oder nicht wirksam ist und das Frakturrisiko hoch erscheint, können antiresorptive und anabole Medikamente in Betracht gezogen werden, wobei die potenziellen unerwünschten Wirkungen bei Schwangerschaften bei Frauen im gebärfähigen Alter berücksichtigt werden sollten. Die bisher durchgeführten Studien waren in der Regel klein und hatten kurze Nachbeobachtungszeiträume, und sie bewerteten KMD-Veränderungen als primären Endpunkt, während die Verringerung des Frakturrisikos sowohl durch antiresorptive und knochenbildende Behandlung bis dato nicht nachgewiesen werden konnte (1).
Die Verwendung von Zoledronat bei prämenopausalen Patientinnen mit Mammakarzinom hat in der Studie der Austrian Breast and Colorectal Cancer Study Group 12 (ABCSG-12) eindeutig gezeigt, dass sie den mit der adjuvanten endokrinen Therapie verbundenen Knochenverlust verhindert, die Evidenz für die Verhinderung von Frakturen ist jedoch begrenzt (36). Ein Behandlungsalgorithmus für Patientinnen mit Mammakarzinom im Frühstadium, einschliesslich prämenopausaler Frauen, die eine adjuvante endokrine Therapie erhalten, wurde im Jahr 2021 veröffentlicht (37). Die Behandlung mit Bisphosphonaten verbessert nachweislich auch die KMD bei verschiedenen anderen Grunderkrankungen bei jungen Menschen wie Anorexia nervosa (hauptsächlich an der Lendenwirbelsäule), chronische inflammatorische Darmerkrankungen, Mukoviszidose, Thalassämie major und Glukokortikoid-induzierter Osteoporose, aber Daten zu Frakturen fehlen weitgehend (38). Für Leitlinien zur Behandlung der Glukokortikoid-induzierten Osteoporose bei jungen Menschen ist auf die aktuelle Leitlinie der European Calcified Tissue Society (ECTS) von 2024 verwiesen (39). Eine retrospektive, multizentrische Studie mit 52 Patientinnen mit PLAO zeigte, dass die KMD ohne pharmakologische Behandlung anstieg, wobei grössere KMD-Anstiege unter eine Behandlung mit Bisphosphonaten und Teriparatid zu verzeichnen waren (40). Nichtsdestotrotz erlitten etwa 19 % der Patientinnen in allen drei Gruppen eine neue Fraktur während der Nachbeobachtungszeit von 36 Monaten (40). Eine ähnlich grössere Zunahme der KMD an der Lendenwirbelsäule wurde dokumentiert in einer retrospektiven Studie an Frauen mit PLAO und multiplen Frakturen, die ein Jahr lang mit Teriparatid behandelt wurden (15.5 % ± 6.6), verglichen mit Kontrollen (7.5 % ± 7.1) (41). Ähnliche KMD-Anstiege wurden bei Patientinnen mit idiopathischer Osteoporose durch die Behandlung mit Teriparatid beobachtet (42).
Mögliche teratogene Wirkungen von Osteoporosetherapeutika
Bei jungen Frauen mit bekannter Osteoporose und Fragilitätsfrakturen, die eine zukünftige Schwangerschaft wünschen, ist es wichtig, die Auswirkungen der Schwangerschaft und insbesondere der Stillzeit auf die Knochengesundheit und den Zeitpunkt der Einnahme knochenaktiver Medikamente zu besprechen. In einer kleinen Fall-Kontroll-Studie wurden keine schwerwiegenden teratogenen Wirkungen von Bisphosphonaten festgestellt, aber eine mögliche negative Auswirkung auf die Rate der neonatalen Komplikationen und die Lebendgeburtenrate konnte nicht ausgeschlossen werden (43). Wegen der Retention von Bisphosphonaten in den Knochen wird im Allgemeinen davon abgeraten, eine Behandlung mit Bisphosphonaten zu beginnen, wenn innerhalb von 1 Jahr eine Schwangerschaft geplant ist (27). Es gibt keine Daten beim Menschen über die Sicherheit von Teriparatid, Denosumab oder Romosozumab bei schwangeren Frauen, aber da diese Medikamente nicht in den Knochen retiniert werden, kann davon ausgegangen werden, dass wenn sie vor einer Schwangerschaft abgesetzt werden, keine teratogenen Wirkungen haben (27, 44). Es ist weder bekannt, ob ihre Wirkungen bestehen bleiben, wenn keine Nachbehandlung mit Bisphosphonaten angeschlossen wird, noch ist bekannt, ob beim Absetzen von Denosumab das gleiche Risiko für ein Rebound-Phänomen wie bei postmenopausalen Frauen besteht (44).
Klinische Relevanz
Die Behandlung der prämenopausalen Osteoporose umfasst die Behandlung der Grunderkrankung, die nicht pharmakologische Optimierung der Knochengesundheit und die Erwägung einer pharmakologischen Behandlung bei anhaltendem Knochenverlust / Fragilitätsfrakturen.
Zusammenfassung und Schlussfolgerungen
Die prämenopausale Osteoporose stellt nach wie vor eine diagnostische Herausforderung dar. Eine sorgfältige klinische, radiologische und biochemische Evaluation ist wichtig, um zugrunde liegende sekundäre Ursachen zu erkennen. Diese sollten immer vor dem Verdacht auf eine monogenetische Form der Osteoporose vorausgehen. Neue Entwicklungen bezogen auf fortschrittlichen radiologischen Bildgebungsverfahren sowie Gentests könnten in Zukunft mehr Einblick in die zugrunde liegenden Knochendefekte geben und den Bedarf an invasiven Knochenbiopsien verringern. Die genetische Diagnostik gibt den betroffenen Personen und ihren Familien Informationen über die Ursache der Osteoporose und über die Art der Vererbung. Die Ergebnisse werden auch Auswirkungen auf die medizinische Versorgung und Nachsorge haben. Weil es nur sehr wenige Belege für die Wirksamkeit von knochenaktiven Medikamenten gibt, ist es wichtig, ihren Einsatz im Rahmen eines personalisierten Ansatzes zu erwägen. In der Regel werden pharmakologische Therapien nach einer Optimierung des Lebensstils, einer ausreichenden Kalzium- und Vitamin-D-Supplementierung und einer Behandlung der Grunderkrankung und unter Berücksichtigung der Pläne für eine zukünftige Schwangerschaft bei Frauen im gebärfähigen Alter angesetzt.
Elena Tsourdi führt klinische Studien mit Alexion, Amgen, Amolyt, Ascendis, Kyowa Kirin und UCB durch und erhielt Honorare für Vorträge oder Erstellung von Lehrmaterial von Alexion, Amgen, Ascendis und UCB.
1. Pepe J, Body JJ, Hadji P, McCloskey E, Meier C, Obermayer-Pietsch B, et al. Osteoporosis in premenopausal women: a clinical Narrative Review by the ECTS and the IOF. J Clin Endocrinol Metab. 2020;105:dgaa306.
2. Ali M, Camacho PM. Workup and management of premenopausal osteoporosis. Endocrinol Metab Clin North Am. 2024;53:597-606.
3. Hosmer WD, Genant HK, Browner WS. Fractures before menopause: a red flag for physicians. Osteoporos Int. 2002;13:337-341.
4. Lewiecki EM, Gordon CM, Baim S, Binkley N, Bilezikian JP, Kendler DL, et al. Special report on the 2007 adult and pediatric Position Development Conferences of the International Society for Clinical Densitometry. Osteoporos Int. 2008;19:1369-1378.
5. Ferrari S, Bianchi ML, Eisman JA, Foldes AJ, Adami S, Wahl DA,Ramchand, S.K. and Leder, B.Z. Sequential therapy for the long-term treatment of postmenopausal osteoporosis. J Clin Endocrinol Metab, 2024. 109(2) : p. 303-311.
6. Bonjour JP, Theintz G, Buchs B, Slosman D, Rizzoli R. Critical years and stages of puberty for spinal and femoral bone mass accumulation during adolescence. J Clin Endocrinol Metab. 1991;73:555-563.
7. Chen S, Jain M, Jhangiani S, Akdemir ZC, Campeau PM, Klein RF, et al. Genetic burden contributing to extremely low or high bone mineral density in a senior male population from the Osteoporotic Fractures in Men Study (MrOS). JBMR Plus. 2020;4:e10335.
8. Rivadeneira F, Styrkársdottir U, Estrada K, Halldórsson BV, Hsu YH, Richards JB, et al. Twenty bone-mineral-density loci identified by large-scale meta-analysis of genome-wide association studies. Nat Genet. 2009;41:1199-1206.
9. Zhu X, Bai W, Zheng H. Twelve years of GWAS discoveries for osteoporosis and related traits: advances, challenges and applications. Bone Res. 2021;9:23.
10. Morris JA, Kemp JP, Youlten SE, Laurent L, Logan JG, Chai RC, et al. An atlas of genetic influences on osteoporosis in humans and mice. Nat Genet. 2019;51:258-266.
11. Lu T, Zhou S, Wu H, Forgetta V, Greenwood CMT, Richards JB. Improved prediction of fracture risk leveraging a genome-wide polygenic risk score. Genome Med. 2021;13:16.
12. Busse E, Lee B, Nagamani SCS. Genetic evaluation for monogenic disorders of low bone mass and increased bone fragility: what clinicians need to know. Curr Osteoporos Rep. 2024;22:308-317.
13. Khosla S, Monroe DG. Regulation of Bone Metabolism by Sex Steroids. Cold Spring Harb Perspect Med. 2018 Jan 2;8(1):a031211
14. Dombrowski S, Jakob L, Hadji P, Kostev K. Oral contraceptive use and fracture risk-a retrospective study of 12,970 women in the UK. Osteoporos Int. 2017;28:2349-2355.
15. Duckham RL, Baxter-Jones AD, Johnston JD, Vatanparast H, Cooper D, Kontulainen S. Does physical activity in adolescence have site-specific and sex-specific benefits on young adult bone size, content, and estimated strength? J Bone Miner Res. 2014;29:479-486.
16. Moreira Kulak CA, Schussheim DH, McMahon DJ, Kurland E, Silverberg SJ, Siris ES, et al. Osteoporosis and low bone mass in premenopausal and perimenopausal women. Endocr Pract. 2000;6:296-304.
17. Panday K, Gona A, Humphrey MB. Medication-induced osteoporosis: screening and treatment strategies. Trends Endocrinol Metab. 2014;25:197-211.
18. Henneicke H, Gasparini SJ, Brennan-Speranza TC, Zhou H, Seibel MJ. Glucocorticoids and bone: local effects and systemic implications. Trends Endocrinol Metab. 2014;25:197-211.
19. Kyvernitakis I, Kostev K, Hadji P. The tamoxifen paradox-influence of adjuvant tamoxifen on fracture risk in pre- and postmenopausal women with breast cancer. Osteoporos Int. 2018;29:2557-2564.
20. Surrey E, Taylor HS, Giudice L, Lessey BA, Abrao MS, Archer DF, et al. Long-term outcomes of elagolix in women with endometriosis: results from two extension studies. Obstet Gynecol. 2018;132:147-160.
21. Cohen A, Dempster DW, Recker RR, Stein EM, Lappe JM, Zhou H, et al. Abnormal bone microarchitecture and evidence of osteoblast dysfunction in premenopausal women with idiopathic osteoporosis. J Clin Endocrinol Metab. 2011;96:3095-3105.
22. Kalkwarf HJ, Specker BL. Bone mineral changes during pregnancy and lactation. Endocrine. 2002;17:49-53.
23. Kovacs CS, Ralston SH. Presentation and management of osteoporosis presenting in association with pregnancy or lactation. Osteoporos Int. 2015;26:2223-2241.
24. Cohen A. Bone metabolism, bone mass, and bone structure during pregnancy and lactation: normal physiology and pregnancy and lactation-associated osteoporosis. Endocrinol Metab Clin North Am. 2024;53:453-470.
25. Butscheidt S, Tsourdi E, Rolvien T, Delsmann A, Stürznickel J, Barvencik F, et al. Relevant genetic variants are common in women with pregnancy and lactation-associated osteoporosis (PLO) and predispose to more severe clinical manifestations. Bone. 2021;147:115911.
26. Cohen A, Kamanda-Kosseh M, Dempster DW, Zhou H, Müller R, Goff E, et al. Women with pregnancy and lactation-associated osteoporosis (PLO) have low bone remodeling rates at the tissue level. J Bone Miner Res. 2019;34:1552-1561.
27. Langdahl BL. Osteoporosis in premenopausal women. Curr Opin Rheumatol. 2017;29:410-415.
28. Rozental TD, Johannesdottir F, Kempland KC, Bouxsein ML. Characterization of trabecular bone microstructure in premenopausal women with distal radius fractures. Osteoporos Int. 2018;29:409-419.
29. Wu F, Wills K, Laslett LL, Riley MD, Oldenburg B, Jones G, et al. Individualized fracture risk feedback and long-term benefits after 10 years. Am J Prev Med. 2018;54:266-274.
30. Chan CY, Mohamed N, Ima-Nirwana S, Chin KY. A review of knowledge, belief and practice regarding osteoporosis among adolescents and young adults. Int J Environ Res Public Health. 2018;15:1727.
31. Arazi H, Samadpour M, Eghbali E. The effects of concurrent training (aerobic-resistance) and milk consumption on some markers of bone mineral density in women with osteoporosis. BMC Womens Health. 2018;18:202.
32. Tabatabai LS, Bloom J, Stewart S, Sellmeyer DE. A randomized controlled trial of exercise to prevent bone loss in premenopausal women with breast cancer. J Womens Health (Larchmt). 2019;28:87-92.
33. Peris P, Monegal A, Martinez MA, Moll C, Pons F, Guanabens N (2007) Bone mineral density evolution in young premenopausal women with idiopathic osteoporosis. Clin Rheumatol. 2007;26:958-961.
34. Islam MZ, MZ, Shamim AA, Viljakainen HT, Akhtaruzzaman M, Jehan AH, Khan HU et al. Effect of vitamin D, calcium, and multiple micronutrient supplementation on vitamin D and bone status in Bangladeshi premenopausal garment factory workers with hypovitaminosis D: a double-blinded, randomised, placebo-controlled 1-year intervention. Br J Nutr. 2010;104:241-247.
35. Kanis JA, Cooper C, Rizzoli R, Reginster JY; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). Executive summary of the European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Calcif Tissue Int. 2019;104:235-238.
36. Gnant M, Mlineritsch B, Luschin-Ebengreuth G, Kainberger F, Kassmann H, Piswanger-Solkner JC et al. Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 5-year follow-up of the ABCSG-12 bone-mineral density substudy. Lancet Oncol. 2008;9:840-849.
37. Waqas K, Lima Ferreira J, Tsourdi E, Body JJ, Hadji P, Zillikens MC. Updated guidance on the management of cancer treatment-induced bone loss (CTIBL) in pre- and postmenopausal women with early-stage breast cancer. J Bone Oncol. 2021;28:100355.
38. Ferrari S, Bianchi ML, Eisman JA, Foldes AJ, Adami S, Wahl DA, et al. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int. 2012;23:2735-2748.
39. Paccou J, Yavropoulou MP, Naciu AM, Chandran M, Messina OD, Rolvien T, et al. Prevention and treatment of glucocorticoid-induced osteoporosis in adults: recommendations from the European Calcified Tissue Society. Eur J Endocrinol. 2024;191:G1-G17.
40. Laroche M, Talibart M, Cormier C, Roux C, Guggenbuhl P, Degboe Y. Pregnancy-related fractures: a retrospective study of a French cohort of 52 patients and review of the literature. Osteoporos Int. 2017;28:3135-3142.
41. Hong N, Kim JE, Lee SJ, Kim SH, Rhee Y. Changes in bone mineral density and bone turnover markers during treatment with teriparatide in pregnancy- and lactation-associated osteoporosis. Clin Endocrinol (Oxf). 2018;88:652-658.
42. Cohen A, Kousteni S, Bisikirska B, Shah JG, Manavalan JS, Recker RR, et al. IGF-1 receptor expression on circulating osteoblast progenitor cells predicts tissue-based bone formation rate and response to teriparatide in premenopausal women with idiopathic osteoporosis. J Bone Miner Res. 2017;32:1267-1273.
43. Sokal A, Elefant E, Leturcq T, Beghin D, Mariette X, Seror R. Pregnancy and newborn outcomes after exposure to bisphosphonates: a case-control study. Osteoporos Int. 2019;30:221-229.
44. Mäkitie O, Zillikens MC. Early-onset osteoporosis. Calcif Tissue Int. 2022;110:546-561.





