- Schmerztherapie in der Palliative Care
Einleitung
Palliative Care setzt sich zum Ziel, die Lebensqualität von chronisch erkrankten Personen mit einer reduzierten Lebenserwartung zu verbessern (1). Schmerz ist ein Symptom, unter dem Patienten im Verlauf einer Erkrankung unterschiedlich stark leiden, eine Reevaluation der Therapie sowie eine Adaption der Massnahmen im Krankheitsverlauf sind wichtig (2). Schmerz ist unabhängig von der Grunderkrankung eines der belastendsten und häufigsten Symptome am Lebensende (3). So leiden ca. 66 % der Betroffenen mit fortgeschrittener oder terminaler Krebserkrankung unter Schmerzen. Dies führt zu Beeinträchtigung der Lebensqualität, der Funktionalität und zu psychischer Belastung. Bestimmte Krebstypen wie Pankreas- oder ORL-Tumoren sind besonders häufig mit Schmerzen assoziiert (4).
Die meisten Empfehlungen und Leitlinien gründen auf Therapien bei Patienten mit malignen Erkrankungen. Die AWMF-Leitlinie für Palliativmedizin/S3-Leitlinie bezieht sich explizit auf die Therapie bei onkologischen Erkrankungen. In der Einleitung ist folgender Hinweis zu lesen: «… inwiefern die Empfehlungen auf Patienten mit nicht onkologischen Erkrankungen angewendet werden können, muss im Einzelfall geprüft werden» (5). In der Medizin und auf den Notfallstationen überwiegt jedoch die Anzahl älterer, multimorbider Patienten mit nicht onkologischen, akuten oder chronisch-progredienten lebenslimitierenden Erkrankungen. Zu letzteren gehören u. a. Herzinsuffizienz, chronisch-obstruktive Lungenerkrankung (COPD), fortgeschrittene Niereninsuffizienz oder neurologische Erkrankungen, wie z.B. die Amyotrophe Lateralsklerose (ALS) und der M. Parkinson (6). Zu Beginn einer Parkinson-Erkrankung beispielsweise leiden 20 % der Betroffenen unter Schmerzen, im Verlauf der Erkrankung bis zu 80 % (7). Für Patientinnen und Patienten mit fortgeschrittenen ischämischen Herzerkrankungen gehören Schmerzen oft zum Alltag (8).
Trotz der langjährigen Verfügbarkeit von Leitlinien, wie z. B. der WHO-Stufenleiter, ist die Behandlung bei einem Drittel der Betroffenen nach wie vor unzureichend (9). Schmerz in der Palliative Care ist ein komplexes Symptom, welches im Rahmen des bio-psycho-sozialen und spirituellen Konzeptes eingeordnet und behandelt werden muss.
Definitionen
Schmerz ist ein subjektives «unangenehmes Sinnes- und Gefühlserlebnis» (10). Die Definition der IASP (International Association for the Study of Pain) schliesst die emotionalen Anteile des Schmerzes mit ein, unabhängig von der Ursache und dem Ort der Entstehung der Schmerzen. Subjektiv bedeutet, dass die Beurteilung, ob ein Schmerz stark oder schwach ist, ob adäquat erscheinend, immer nur vom Patienten selbst beurteilt werden kann und durch die persönliche Erfahrung geprägt ist.
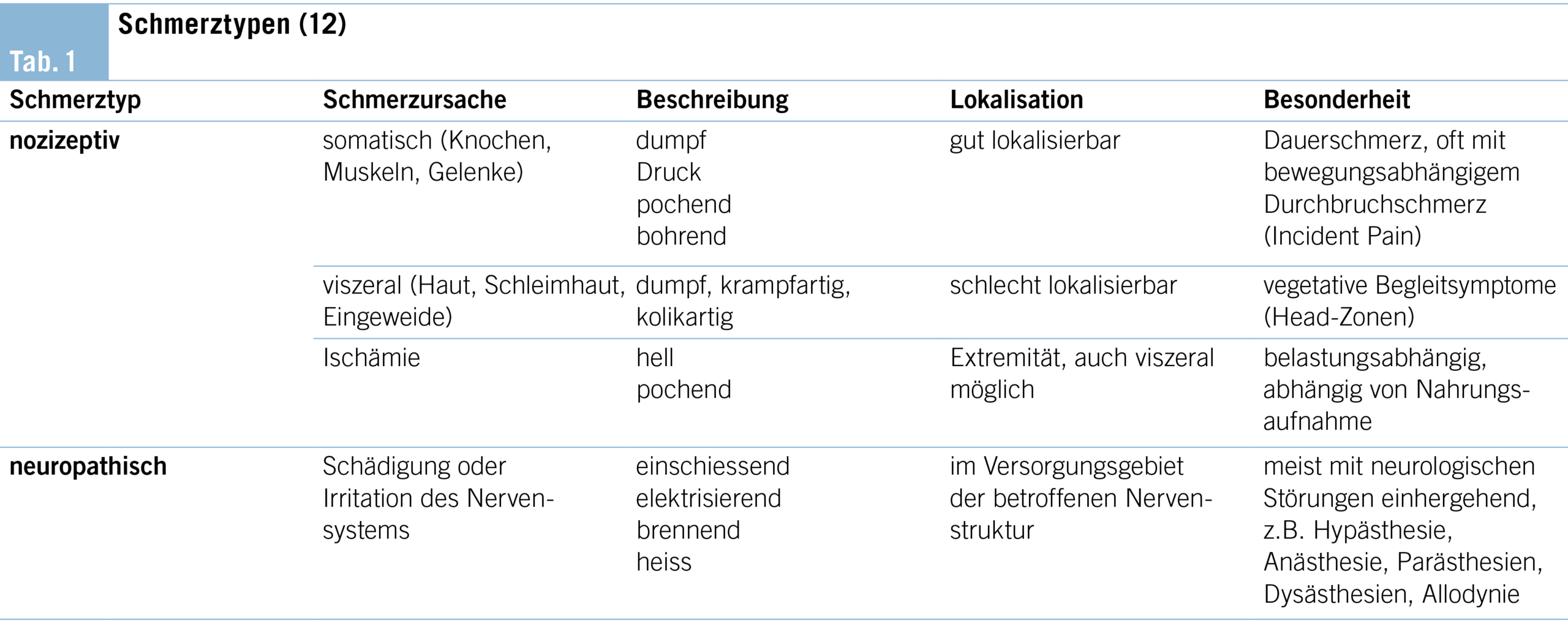
Je nach Ursache des Schmerzreizes spricht man von nozizeptivem und neuropathischem Schmerz (Tab. 1). Nozizeptoren sind rezeptive Strukturen auf der Oberfläche freier Nervenendigungen, welche die Stärke und den zeitlichen Verlauf u.a. von mechanischen und thermischen Reizen messen, welche kortikal als Schmerz wahrgenommen werden (11). Nozizeptoren kommen nahezu in allen Organen vor, mit grösster Dichte in der Haut, nicht aber im Gehirn und in der Leber. Die Nozizeptoren der inneren Organe vermitteln einen oft dumpfen, schlecht lokalisierbaren Schmerz, der auf Hautareale übertragen werden kann, die von demselben Rückenmarkssegment innerviert werden wie das schmerzende Organ. Diese Hautzonen werden als Head-Zonen bezeichnet (12).
Bei den neuropathischen Schmerzen kommt es zu einer Schädigung im Nervensystem, die unter anderem zu salvenartigen Impulsbildungen im Versorgungsgebiet führen und von den Patienten als blitzartig und einschiessend bezeichnet werden (11). Mögliche Ursachen sind neben mechanischen Verletzungen und einwachsenden Metastasen bspw. auch Stoffwechselstörungen und systemische Noxen (u.a. Diabetes mellitus oder Chemotherapeutika) mit daraus folgender Polyneuropathie. Diese Einteilung ist wichtig für die Therapieplanung.
Der Begriff Durchbruchschmerz beschreibt eine vorübergehende Schmerzexazerbation, die bei Patienten mit relativ konstanten und angemessen kontrollierten Dauerschmerzen auftritt (13).
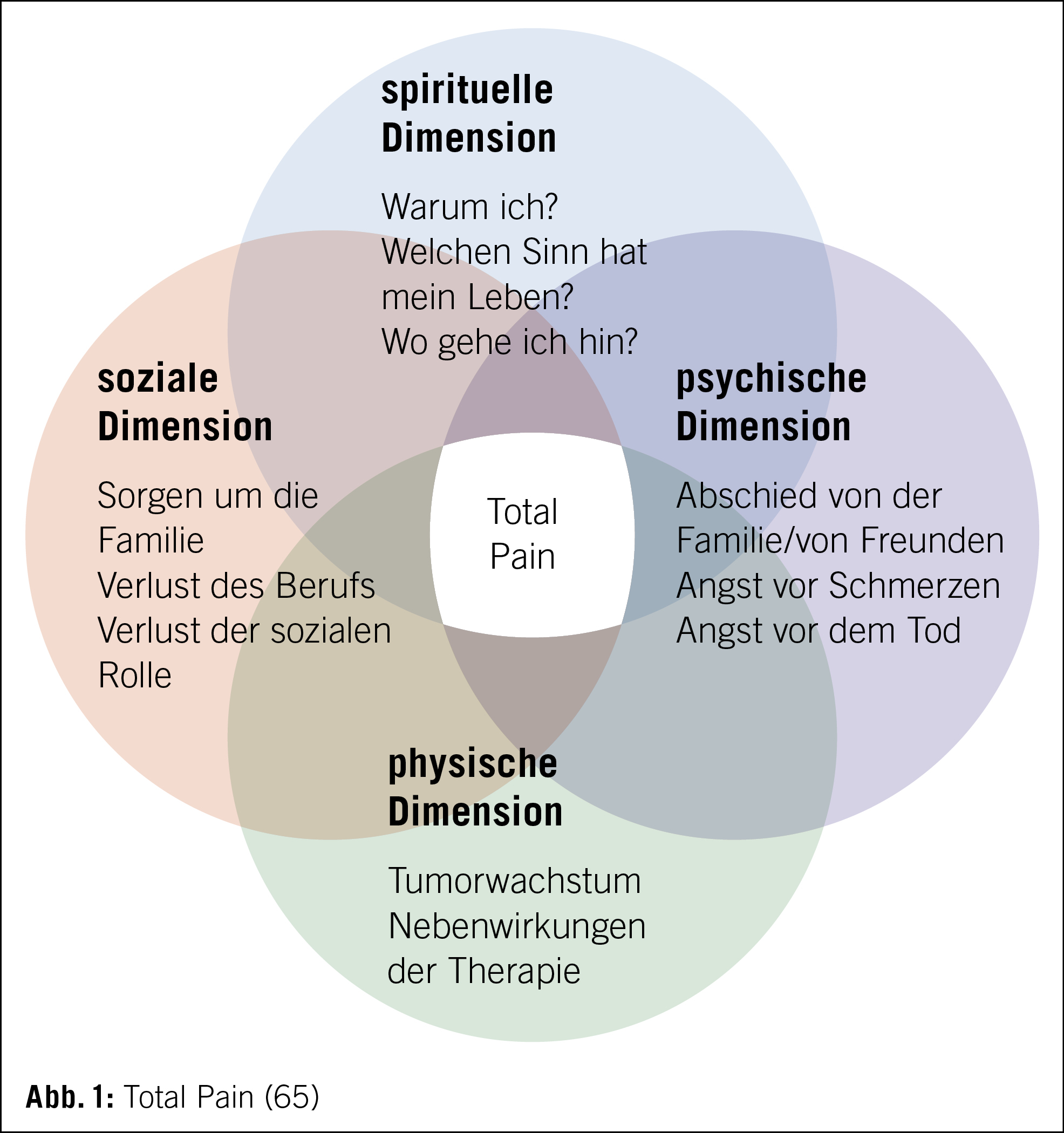
Palliative Care beugt Leiden und Komplikationen vor. Sie umfasst medizinische Behandlungen, pflegerische Interventionen sowie psychologische, soziale und spirituelle Unterstützung (14). Die spirituelle Komponente ergänzt das bio-psycho-soziale Schmerzmodell nach Engel (15). Palliative Patienten sprechen nicht nur von Schmerzen und anderen Symptomen, sondern äussern zusammen mit diesen Beschwerden auch seelische, soziale und spirituelle Not (16). Schenkt man diesen Einflussfaktoren keine oder zu wenig Beachtung, bringt die medikamentöse Behandlung womöglich nicht den gewünschten Effekt. Cicely Saunders, Pionierin der modernen Hospizbewegung und Begründerin unseres heutigen Verständnisses von Palliative Care, hat in diesem Zusammenhang in den 1960er- Jahren den Begriff des Total Pain (Abb. 1) geprägt.
In der Palliativmedizin wird Schmerz mehrdimensional gesehen. Schmerz entsteht durch physische, psychische, soziale und spirituelle Stressoren (17). Das Konzept Total Pain bezieht sich auf einen refraktären Schmerz, ein Leiden, das über die physische Dimension hinausgeht (18, 19, 20).
Belastungen in den vier Dimensionen des Total-Pain-Konzeptes können somatisch bedingte Schmerzen verstärken. Dank des multiprofessionellen Ansatzes in der Palliative Care kann lindernd auf Total Pain eingewirkt werden.
Erfassung
Für die Erfassung der Schmerzstärke gibt es verschiedene Messmodelle (21). Am häufigsten wird die Numeric Rating Scale (NRS) mit einer 10-Punkte-Skala von 0 bis 10 verwendet. Die Erfassung sollte routinemässig und in festen Zeitabständen erfolgen, immer auch nach Gabe eines Schmerzmittels, damit dessen Effektivität beurteilt werden kann. Bei älteren Menschen, Patientinnen und Patienten mit eingeschränkter Kommunikationsfähigkeit und/oder kognitiver Beeinträchtigung ist die Selbsteinschätzung mittels NRS oft nicht zuverlässig anwendbar. Hier greift man auf Fremdbeobachtungsskalen zurück, welche insbesondere drei Verhaltenskategorien berücksichtigen. Diese sind Mimik, Lautäusserungen und Körperbewegungen bzw. -haltung. Ein Fragebogen, der diese Elemente aufnimmt, ist z.B. der Doloplus-2, welcher auch in vielen Sprachen verfügbar ist (22).
Für die Schmerzanamnese ist das Akronym SOCRATES hilfreich:
– Site (Ort)
– Onset (Beginn)
– Character (Schmerzcharakter)
– Radiation (Ausstrahlung)
– Associated Factors (assoziierte Faktoren)
– Timing (Zeitpunkt)
– Exacerbating and Relieving Factors (verschlimmernde und lindernde Faktoren)
– Severity (Ausprägung/Schweregrad) (23, 24)
Parallel soll bei der Anamnese die Schmerzart eingeschätzt werden: nozizeptiv oder neuropathisch. Eine Kombination von nozizeptivem und neuropathischem Schmerzcharakter ist möglich und häufig. Auch sollte eingeordnet werden, ob der Schmerz in Zusammenhang mit der Grunderkrankung steht, also z.B. als Tumorschmerz, oder einer anderen Erkrankung zugeordnet werden kann, wie z.B. einer Post-Zoster-Neuralgie oder durch die Rigidität bei Morbus Parkinson.
Zusätzlich zur klinischen Untersuchung soll eine umfassende Anamnese im Sinne des Konzeptes von Total Pain mit dem Erkrankten und den Angehörigen erfolgen: Körperliche und kognitive Ressourcen, kommunikative Fähigkeiten, kultureller Hintergrund, Religionszugehörigkeit und Krankheitssicht beeinflussen den Umgang mit Schmerzen. Die Erwartungen von Patientinnen und Patienten sowie ihren Angehörigen sollten erfasst und, sofern unrealistische Erwartungen bestehen, in einem Gespräch die Ursachen, Therapiemöglichkeiten und Therapieziele gemeinsam besprochen werden.
Essenziell ist, dass die Schmerzerfassung repetitiv erfolgt, damit auf Veränderungen, wie sie z. B. mit Fortschreiten der Grunderkrankung erfolgen, reagiert werden kann (4).
Therapie
Verschiedene Schmerzzustände erfordern verschiedene Massnahmen. Patientinnen und Patienten der Palliative Care benötigen einen individuellen Therapieansatz. Ein multidisziplinäres und multimodales Vorgehen ist häufig erforderlich. Es ist wichtig, Etappenziele in der Schmerzbehandlung zu definieren, wie beispielsweise:
1. Verbesserung des Schlafs
2. Verbesserung der Schmerzkontrolle in Ruhe
3. Verbesserung bei körperlicher Aktivität
Die Verbesserung bei körperlicher Aktivität kann leider nicht immer komplett erreicht werden (24, 20). Wenn passend, gewünscht und möglich, sollte die Behandlung der Grunderkrankung, wie z.B. in der Onkologie die Therapie des Gewebeschadens durch die Neoplasie mit Radiotherapie, Chemotherapie, Biologicals und/oder Chirurgie, erfolgen. Diese Massnahmen haben dann oft Schmerzlinderung zur Folge. In der Neurologie kann die Anpassung der Parkinson-Therapie eine solche schmerztherapeutische Intervention darstellen.
Nicht pharmakologische Massnahmen
In einem kürzlich erschienenen Review beschreibt van Veen als schmerzlindernde, nicht pharmakologische Massnahmen den Einsatz von Massage und Virtual Reality. Wohingegen für Kunsttherapie keine hinreichende Evidenz nachgewiesen werden konnte, ebenso im Hinblick auf mindful breathing interventions. Vielversprechende Resultate zeigten Hypnose, Progressive Muskelrelaxation, cognitive-behavioral audiotapes, warmes Fussbad mit Wickel, Reflexzonenmassage und Musiktherapie.
Musiktherapie und Körperanwendungen/Massage werden häufig angewendet, aber auch Akupunktur, Physiotherapie und Aromatherapie. Wenngleich nicht immer wissenschaftlich bewiesen, soll man sich bei nicht medikamentösen harmlosen Massnahmen individuell durch das Wohlbefinden des kranken Menschen leiten lassen.
Die Anwendung von Transcutaneous Electric Nerve Stimulation (TENS) kann bei neuropathischen Schmerzen sehr erfolgreich sein (26, 27).
Pharmakologische Massnahmen
Die sechs wichtigsten Schritte, welche bei der Verwendung von Analgetika bei palliativen Patientinnen und Patienten mit Krebs oder anderen fortgeschrittenen Krankheiten angewendet werden sollten, entsprechen den WHO-Leitlinien (28, 29, 30, 31):
1. By the clock: Die Einnahme sollte in fixen Intervallen entsprechend der Wirkdauer des Medikaments erfolgen. Bis das Wohlbefinden erreicht ist, sollte die Dosis schrittweise gesteigert werden.
2. By the mouth: Wenn immer möglich sollte das Arzneimittel oral verabreicht werden.
3. For the individual: Die Einordnung des Schmerzes nach: a) Schmerzcharakter (nozizeptiv versus neuropathisch versus gemischt); b) Ursprungsort des Schmerzbildes. Die Dosis soll nach individuellem Bedarf auftitriert werden, bis das persönlich akzeptable Schmerzniveau erreicht ist.
4. As Required: Es sollten immer Reservemedikamente verordnet werden.
5. Effektivität messen und dokumentieren, wie bereits im Abschnitt «Erfassung» beschrieben.
6. Attention to detail: Berücksichtigung der Tagesstruktur bei Festlegung des Einnahmezeitpunkts der Analgetika. Erstellung eines Medikamentenplans mit Basis- und Reservemedikation. Nebenwirkungen sollten besprochen, erfasst und wenn möglich behandelt werden.
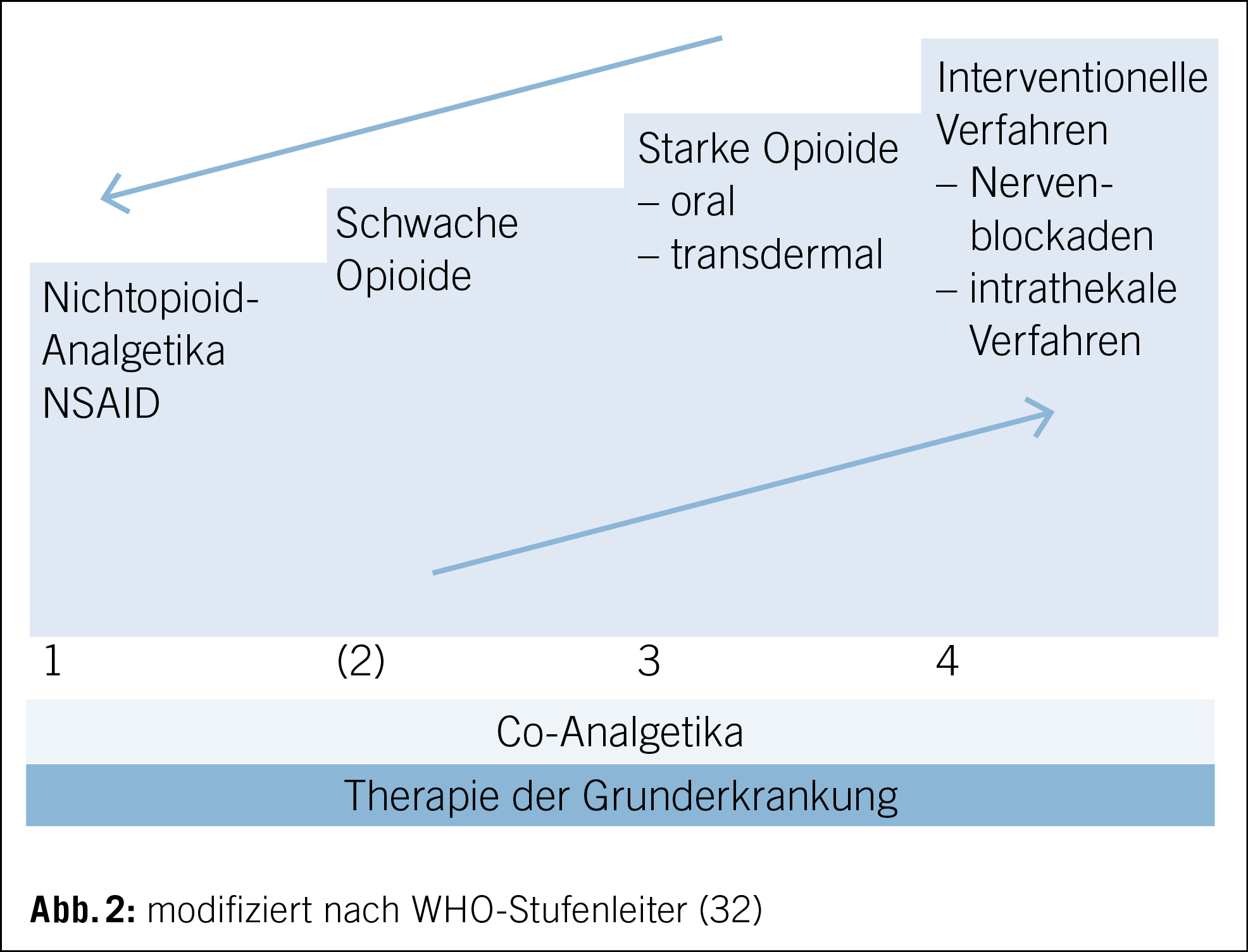
Für die Einteilung der Analgetika hat sich die WHO-Stufenleiter bewährt (Abb. 2). Diese wurde 1986 erstmals als Hilfsmittel bei Tumorschmerzen empfohlen und seither stetig weiterentwickelt. Der Einsatz hat sich auch ausserhalb des Bereichs der Tumorschmerzen etabliert. Hierbei entspricht Stufe 1 Non-Opioiden, Stufe 2 und 3 den schwachen bzw. starken Opioiden. Zu den drei genannten Stufen wurde eine vierte hinzugefügt, welche interventionelle analgetische Verfahren beinhaltet, wie bsp. die intrathekale Schmerztherapie. Zudem wurde die Medikamentengruppe der Co-Analgetika hinzugefügt. Von einem initial unidirektionalen Einsatz ist man zu einem bidirektionalen Einsatz übergangen (32).
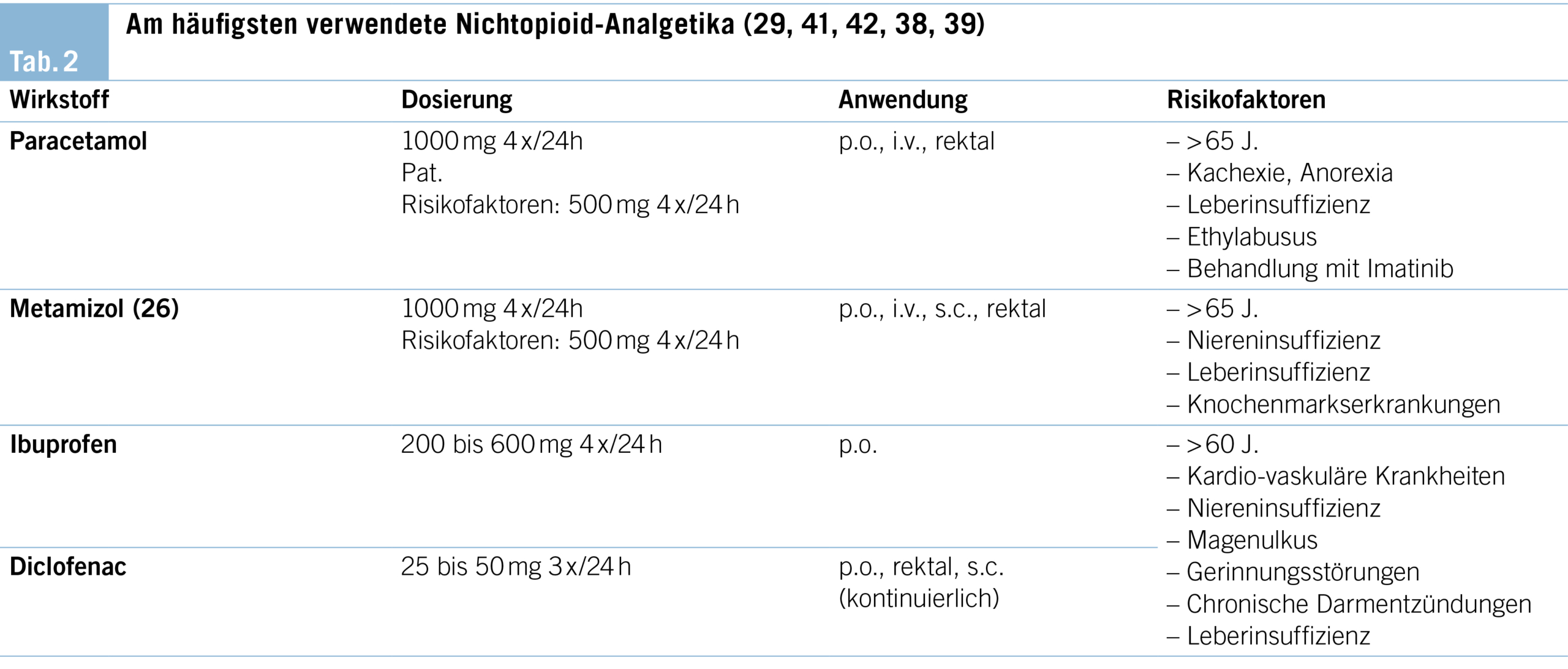
WHO-Stufe 1: Non-Opioide (Tab. 2)
Paracetamol, ein schwacher Hemmer der Cyclooxygenase COX-2 und/oder COX-3, wirkt analgetisch und antipyretisch (33). Paracetamol verfügt über eine eher schwache analgetische Potenz, lässt sich aber gut mit Opioiden kombinieren (34). Bei 4 x täglicher Einnahme kommt es allerdings zu einer erheblichen Tablettenlast. Die langfristige Anwendung sollte somit auf die Patientinnen und Patienten beschränkt werden, die innert eines kurzen Zeitfensters einen klaren Nutzen zeigen (35). Bei älteren, untergewichtigen oder kachektischen Menschen oder bei Leberinsuffizienz resp. Äthylabusus soll die Dosis reduziert und die intravenöse Verabreichung vermieden werden. Die maximale Tagesdosis von 3 bis 4 g/d soll nicht überschritten werden. Paracetamol ist immer noch eine wichtige Ursache von akutem Leberversagen.
Metamizol (Dipyrone) ist bereits seit 1992 auf dem Markt (23). Der genaue Wirkmechanismus ist nach wie vor unklar. Es wirkt analgetisch, antipyretisch und schwach antiphlogistisch. Zudem hat es auch eine spasmolytische Wirkung, weswegen es oft bei viszeralen (kolikartigen) Schmerzen eingesetzt wird. Der Einsatz erfolgt in Monotherapie oder in Kombination mit Opioiden. Die Wirksamkeit auch in niedrigeren Dosen ist belegt. Die Kombination von Morphin und Metamizol kann eine verbesserte Schmerzlinderung erzielen. Obwohl es mit der seltenen, aber gravierenden Nebenwirkung der Agranulozytose assoziiert ist, gilt Metamizol bezüglich gastrointestinaler und nephrologischer Nebenwirkungen viel sicherer als die NSAR (30, 36, 37, 38, 39).
NSAR, Inhibitoren der COX-2 und COX-1, wie bspw. Ibuprofen oder Diclofenac, werden wegen ihrer potenziellen nephrologischen und gastrointestinalen Toxizität weniger häufig angewendet (38, 39). Ein gezielter Einsatz kann wegen der starken antientzündlichen Wirkung sinnvoll sein bei z.B. Knochenmetastasen, Weichteiltumoren oder Metastasen mit einer inflammatorischen Komponente. Für die Indikation Tumorschmerz ist kein NSAR dem anderen überlegen (40). NSAR haben zu der analgetischen auch eine gute antipyretische Wirkung (24, 29). Die selektiven Inhibitoren der COX-2 werden in der Palliativmedizin nur selten angewendet.
WHO-Stufe 2 und 3: Opioide
Opium ist ein Extrakt aus Mohn (Papaver somniferum), das Morphin und andere verwandte Alkaloide enthält. Es wird schon seit Tausenden von Jahren benützt zur Verbesserung des Schlafs, zum Auslösen von Euphorie, zur Analgesie und Behandlung von Diarrhoe. Die Struktur von Morphin wurde 1902 entdeckt, und seither wurden viele synthetische Opioide entwickelt (33). Opioide interagieren mit den Opioidrezeptoren. Es gibt vier verschiedene Opioidrezeptoren: µ, κ, δ und Opioid-like 1 (OPRL-1). Alle klinisch relevanten opioidhaltigen Analgetika sind Agonisten des µ-Rezeptors. Die Affinität für die übrigen Rezeptoren ist von Molekül zu Molekül unterschiedlich. Buprenorphin ist ein «mixed Agonist-Antagonist»-Analgetikum: Agonist am OPRL-1 und am µ-Rezeptor, Antagonist am κ- und δ-Rezeptor (29, 33, 43).
Auch die Nebenwirkungen, hauptsächlich gastrointestinal und zerebral, werden durch Interaktion mit den zentralen und peripheren µ-Rezeptoren verursacht und sind bei allen Molekülen ähnlich (33, 43). Insbesondere zu nennen sind die Nausea, vor allem zu Beginn der Therapie, und die Obstipation, welche unter der Behandlung bestehen bleibt. Zentrale Nebenwirkungen wie Sedation, Delir und Atemdepression oder auch Myoklonien weisen auf Erreichen des toxischen Bereichs hin. Sie bedingen eine Dosisreduktion oder allenfalls eine Antagonisierung mit Naloxon. Bei sorgfältiger Titration in das analgetisch therapeutische Fenster ist das Risiko einer Atemdepression gering (44).
Nach Twycross 2021 (44) steht bei Patientinnen und Patienten mit einer kurzen Überlebensprognose von Wochen bis Monaten die Schmerzlinderung im Vordergrund.
Zu den schwachen Opioiden der WHO-Stufe 2 zählen Codein, Tramadol und Tapentadol. Diese Stufe spielt in der Palliativmedizin nur eine untergeordnete Rolle (begrenzter Effekt, Maximaldosis, zahlreiche Nebenwirkungen, Interaktionen und Unmöglichkeit der Kombination mit Stufe 3). Deshalb ist der Einsatz von niedrig dosierten Stufe-3-Präparaten oft grösser und führt schneller zum Ziel. Aufgrund fehlender Verfügbarkeit von Stufe-3-Präparaten in vielen Ländern wurde die zweite Stufe jedoch belassen (29, 30, 31, 35, 45).
Die starken Opioide der WHO-Stufe 3 sind die Eckpfeiler der palliativmedizinischen Schmerztherapie. Als reine µ-Rezeptoragonisten stehen Morphin, Oxycodon +/– Naloxon, Hydromorphon, Fentanyl und Methadon zur Verfügung. Keines der genannten Präparate zeigte in systematischen Übersichtsarbeiten eine Überlegenheit gegenüber dem anderen (46). Es gibt grundsätzlich keine Kontraindikationen für starke Opioide, falls man mit der richtigen Dosis startet. Alle starken Opioide haben eine ähnliche Wirkung und Verträglichkeit. Bei der Wahl des Moleküls soll man die Verfügbarkeit und patienteneigenen Faktoren berücksichtigen. Morphin, Hydromorphon und Oxycodon sind die Moleküle der ersten Wahl (45). Ohne Kontraindikationen startet man meistens mit Morphin (47). Zu beachten sind die unterschiedlichen Potenzen. Fentanyl ist als potentestes der genannten Opioide zu werten, gefolgt von Hydromorphon, Oxycodon und Morphin. Dieses spiegelt sich in den Äquipotenzen wider, so entsprechen z.B. 4 mg Hydromorphon oral ca. 30 mg Morphin oral.
Ein paar Faustregeln sind bei Therapiebeginn insbesondere bei opioidnaiven Patientinnen und Patienten zu beachten (29):
01) Perorale Gabe von Morphin, wenn möglich
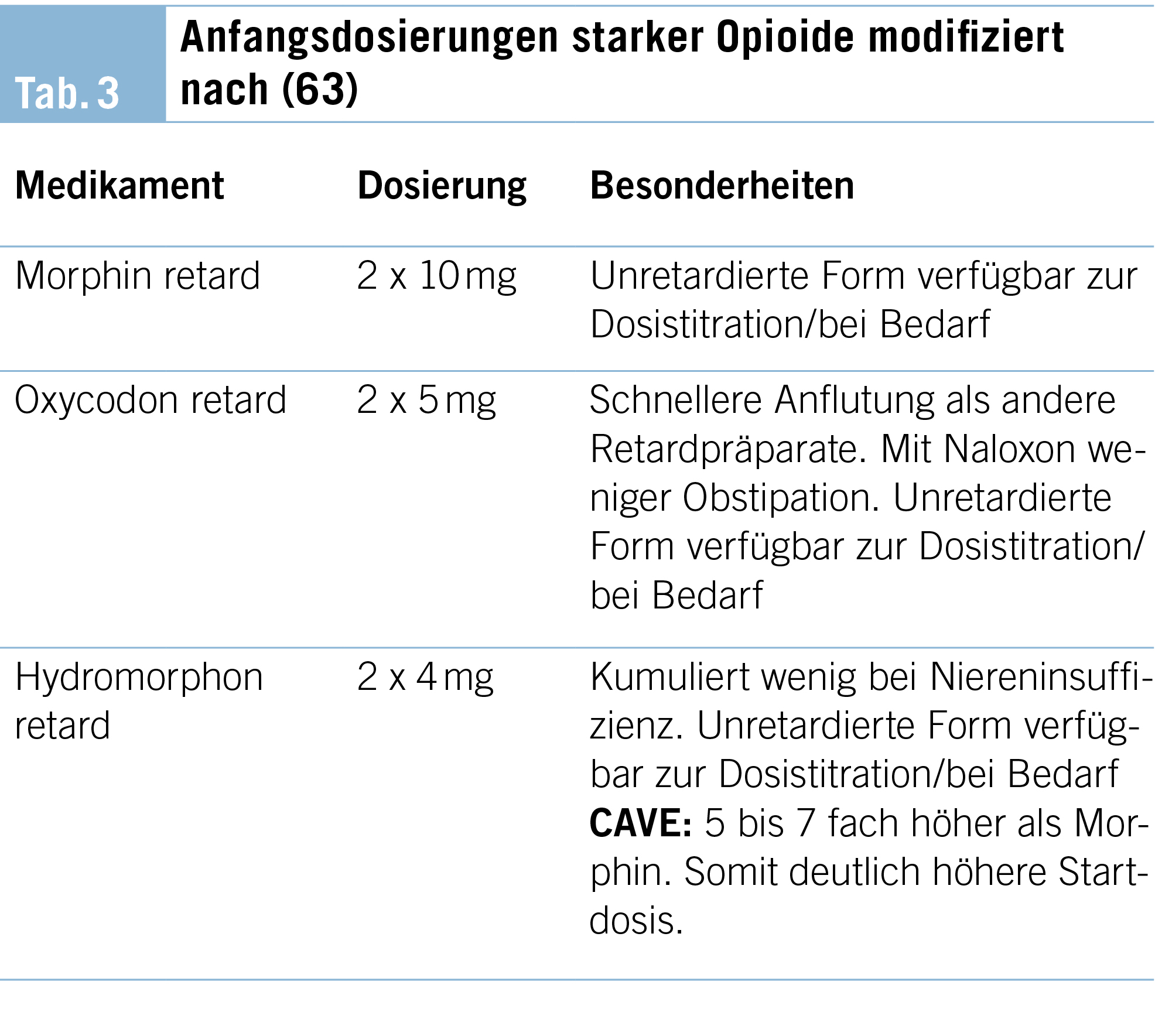
02) Start low – go slow: Mit tiefer Dosis starten, eintitrieren, bis das therapeutische Fenster (gute Analgesie mit minimalen Nebenwirkungen) erreicht ist (Tab. 3)
03) Kombination eines langwirksamen Präparats mit einem kurzwirksamen als Reserve (Bolus).
04) Dosis der Reserve = 1/10 bis 1/6 der Tagesdosis (z.B. bei einer Tagesdosis von 2 x 15 mg retardiertem Morphin ist die Dosis der Reserve 3 bis 5 mg kurzwirksames Morphin, 5 mg eher bei starken Durchbruchschmerzen, z.B. NRS ≥5). Diese Reserveboli können jede Stunde verabreicht werden. Die Wirksamkeit des Reservebolus soll dokumentiert werden, idealerweise 30 bis 45 Minuten nach der Verabreichung.
05) Die benötigte Gesamtdosis der Reserveboli pro 24 Stunden kann am nächsten Tag zur fixen Tagesdosis dazugerechnet werden. Bsp.: Wenn ein Patient mit 2 x 15 mg retardiertem Morphin die letzten 24 Stunden 3 Reserveboli à 3 mg Morphin benötigte, kann die Tagesdosis auf 2 x 20 mg des retardierten Morphins erhöht und die Reservedosis auf 4 mg kurzwirksames Morphin angepasst werden. Die Tagesdosis soll maximal um 50 % erhöht werden.
06) Bei Umstellung von peroral (p.o.) nach intravenös (i.v.) oder subkutan (s.c.) liegt der Umstellungsfaktor zwischen 1:2 und 1:3. Im Alltag hat es sich bewährt, wie folgt umzurechnen (BOX 1):
– p.o. nach s.c.1:2
– p.o. nach i.v. 1:3
07) Starke Opioide (Stufe 3) mit Analgetika der Stufe 1 kombinieren
08) Keine Kombination von Stufe-2- und -3-Analgetika
09) Mit einer laxativen Therapie starten zur Vorbeugung von Obstipation
10) Die Nierenfunktion kontrollieren: bei Niereninsuffizienz wenn möglich Hydromorphon oder Fentanyl (transdermal) einsetzen
11) Zu Beginn der Opioidtherapie entwickeln Patientinnen und Patienten oft vorübergehend Nausea. Man kann während den ersten Tagen Antiemetika wie Domperidon oder Metoclopramid dazugeben, alternativ eine tiefe Dosis Haloperidol oder ein Kortikoid erwägen.
Im Folgenden soll noch auf zwei der starken Opioide gesondert eingegangen werden. Methadon ist wegen seiner stark variablen Halbwertszeit, seiner komplexen Dosierung, seiner unter anderem kardialen Nebenwirkungen und möglicher Stigmatisierung (Einsatz bei Opioid-Agonisten-Therapie) ein Molekül, das nur von Ärztinnen und Ärzten mit entsprechender Erfahrung angewendet werden soll (29). Buprenorphin als gemischter Agonist-Antagonist wird zur Analgesie in der Palliativmedizin sehr selten angewendet.
Falls bei ausgebauter Opioidtherapie eine suboptimale Schmerzkontrolle besteht und/oder unerträgliche Nebenwirkungen auftreten, kann eine Opioidrotation durchgeführt werden: Man rotiert das Molekül oder die Applikationsform. Bei Wechsel des Moleküls erfolgt eine Reduktion der Dosis um 20–30 %. Es gibt auch Karten mit Umrechnungstabellen oder gute Onlineapplikationen wie die des Universitätsspitals Zürich (48).
Liegen Organinsuffizienzen vor, soll vorsichtig und in reduzierter Dosis eintitriert werden. Bei schwerer Leberinsuffizienz gilt es, den Einsatz schwacher Opioide (Stufe 2) zu vermeiden. Generell findet sich eine höhere systemische Exposition der meisten Opioide, sodass eine Dosisreduktion um 50–75 % empfohlen wird. Beim Einsatz eines Oxycodon-Naloxon-Kombinationspräparats muss beachtet werden, dass bei mässiger bis schwerer Leberinsuffizienz Naloxon in der Leber weniger eliminiert wird und somit systemische Wirkung entfalten könnte, was die Wirkung des Oxycodons mindert. Hier sollte das Monopräparat Oxycodon genutzt werden.
Bei Niereninsuffizienz kumulieren Hydromorphon, Oxycodon und Fentanyl weniger bzw. gar nicht. Beachtet werden sollte der Einsatz geringerer Initialdosen, vorsichtige Titration und ein längeres Dosisintervall. Beim Einsatz von Morphin hingegen kommt es zur Kumulation von Metaboliten. Wenn ein Einsatz unumgänglich ist, kann eine sehr vorsichtige Titration (1.25–2.5 mg p.o./s.c. bei Bedarf) mit Wechsel auf ein Fentanyl TTS nach Erreichen der Schmerzkontrolle erwogen werden (35). In der Sterbephase ist der Einsatz von Morphin oft sinnvoll, da einfach verfügbar, i.v. und s.c. applizierbar.
Co-Analgetika in verschiedenen Indikationen
Die Behandlung neuropathischer Schmerzen kann herausfordernd sein. Als Erstlinientherapie gelten die selektiven Serotonin-Noradrenalin-Reuptake-Inhibitoren (SNRI) Duloxetin und Venlafaxin, die trizyklischen Antidepressiva (TZA), von denen einige auch in Tropfenform gegeben werden können, sowie die Antiepileptika Gabapentin und Pregabalin. Als Zweitlinientherapie werden die topischen Therapeutika Capsacin und Lidocain empfohlen. Zudem wird der Einsatz von Tramadol vorgeschlagen. Allerdings zeigt letztgenanntes oft nicht eine ausreichende analgetische Wirkung trotz der zusätzlichen Serotonin-Reuptake-Hemmung. Somit sind die starken Opioide als dritte Linie eine bessere Option. Kombinationen zwischen den Substanzklassen sind sinnvoll (49).
Die Anwendung in dieser Indikation ist meistens «practice-based» und off-label, obwohl es mittlerweile viele randomisierte Studien zu verschiedenen Indikationen gibt, wie z.B. bei Taxan-induzierten neuropathischen Schmerzen (50). Neben Depression und Angststörung sind auch die diabetische und Chemotherapie-induzierte Polyneuropathie Indikationen für den Einsatz von Duloxetin (51, 62). Wegen der Metabolisierung via CYP2D6 gibt es für Amitryptilin, Venlafaxin und Duloxetin viele Interaktionen und je nach Enzymaktivität verschiedene Phänotypen (slow, rapid intermediate Metabolizer), die beachtet werden müssen (52, 53).
Pregabalin und Gabapentin blockieren zentrale Calciumkanäle und hemmen so die Freisetzung von Neurotransmittern wie Glutamat und Noradrenalin. Obwohl als Antiepileptika entwickelt, werden sie aktuell hauptsächlich für die registrierten Indikationen bei neuropathischem Schmerz eingesetzt. Diese Substanzen werden wenig metabolisiert; daher sind Interaktionen seltener. Bei Niereninsuffizienz muss die Dosis reduziert werden, Gabapentin bietet in diesem Fall mehr Möglichkeiten (54, 55).
Bei Leberkapselschmerz, Kopfschmerzen wegen Hirnmetastasen, Obstruktion oder anderen Schmerzen als Folge von Überdruck und Ödem sind Kortikoide (Dexamethason oder Methylprednisolon) sehr hilfreich (24). Beim Einsatz von Dexamethason hat sich eine Dosis zwischen 4 und 16 mg/d bewährt.
Trotz manchmal euphorischer medialer Berichterstattungen gibt es bis jetzt keine Evidenz für Cannabis in der Schmerztherapie (56, 57).
Applikationsformen
Die orale Applikation ist vorzuziehen. Gewisse Arzneimittel können als Schmelztabletten (auf die Zunge, z.B. Lorazepam oder Domperidon) oder sublingual (unter die Zunge, z.B. Buprenorphin oder Nitroglycerin) verabreicht werden. Wenn Erkrankte schwächer werden, verwirrt sind, unter Nausea/Erbrechen oder an einer intestinalen Obstruktion leiden, muss eine alternative Applikationsform gewählt werden. In der Palliativmedizin, vor allem zu Hause, ist dabei oft Kreativität gefragt. Siehe auch Fallbeispiel (BOX 2).
Die transdermale Verabreichung (Transdermale Therapeutische Systeme, TTS) ist für z.B. Buprenorphin und Fentanyl eine elegante und effiziente Lösung, wobei letztgenanntes häufiger genutzt wird. Wichtig ist, dass man genau weiss, welche Dosis notwendig ist, da das Eintitrieren wegen der langen Latenzzeit anspruchsvoll ist. Sie sind nicht für eine unkontrollierte Akutschmerzsituation als erstes Opioid geeignet. Für die Resorption muss ein ausreichendes subkutanes Fettpolster vorhanden sein. Für terminal erkrankte Menschen wird diese Anwendung nicht empfohlen.
Der subkutane Applikationsweg hingegen wird in der Palliativmedizin sehr häufig angewendet. Die Vorteile sind der einfache Zugang und die geringe benötigte Flüssigkeitsmenge. Mittels einer s.c.-Pumpe kann das Arzneimittel kontinuierlich verabreicht werden, die Reserven können als Boli s.c. gespritzt werden. Dieser Zugangsweg ist für sehr viele Moleküle geeignet, wenn auch meistens «off-label». Es besteht jedoch eine jahrelange Erfahrung in der Anwendung (58, 59, 60, 61). Als analgetische Substanzen werden Morphin und Hydromorphon verwendet. Für letzteres muss im ambulanten Einsatz eine Kostengutsprache gestellt werden. Nur bei Erkrankten mit ausgeprägten Ödemen, peripheren Durchblutungsverhältnissen (Resorptionsproblemen) oder Gerinnungsstörungen (Hämatomrisiko) wird die subkutane Verabreichung nicht empfohlen. Bis zu einer Thrombozytenzahl von 10 000/μl ist die s.c.-Gabe problemlos möglich (Erfahrungswert). Die intravenöse Verabreichung ist eine Alternative bei hohen Dosen mit zu grosser Flüssigkeitsmenge für die s.c.-Gabe. Für Notfallsituationen ist die intravenöse Applikation vorzuziehen.
Kopfschmerzen aufgrund von primären Hirntumoren oder Metastasen sprechen häufig sehr gut auf Stufe-1-Analgetika an (Paracetamol/Ibuprofen/Novalgin). Können Betroffene nicht mehr schlucken, ist die rektale Gabe in Erwägung zu ziehen. Fixe Gaben können mit der Körperpflege oder dem Frischmachen nach Wasserlösen oder Stuhlgang verbunden werden.
WHO Stufe 4: Interventionelle Verfahren
Die intrathekale Schmerztherapie mit Opioiden über ein implantiertes Kathetersystem wird der WHO-Stufe 4 zugeordnet. Diese soll als Beispiel für interventionelle Therapien herangezogen werden. Sie kann eine Option bei komplexen Tumorschmerzen sein. Als mögliche Indikationen gelten:
– Therapierefraktäre Schmerzen mit nicht tolerierbarer Schmerzintensität und Beeinträchtigung der Lebensqualität
– Ungenügende Schmerzlinderung oder deutliche Nebenwirkungen durch konservative Opioidtherapie und Co-Analgetika
– Prognose einer kontinuierlichen/fortschreitenden Schmerzproblematik aufgrund des Tumorwachstums oder postinterventioneller Therapiefolgen
Vor einer Implantation müssen psychiatrische Erkrankungen ausgeschlossen bzw. stabilisiert sein, ebenso sollte eine Total-Pain-Komponente beachtet werden. Für eine Implantation ist immer ein stationärer Aufenthalt mit Abstimmung der involvierten Disziplinen notwendig. Auch muss die weitere ambulante Betreuung durch spezialisierte Pflegedienste und ein schmerztherapeutisch anästhesiologisches Team gewährleistet sein (BOX 3) (4).
Zentrumsleiterin
Palliativzentrum
Leitende Ärztin
Schmerzzentrum
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
mirjam.buschor-bichsel@kssg.ch
Leitende Ärztin Palliativzentrum
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Leitende Ärztin, Stv. Zentrumsleiterin
Palliativzentrum
Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St. Gallen
Die Autorinnen haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
1) Schmerzen sind in der Palliative Care bei unterschiedlichen Grunderkrankungen häufig und sollen unter dem bio-psycho-sozialen-spirituellen Aspekt erfasst und beurteilt werden.
2) Für die Schmerzanamnese kann das Akronym SOCRATES genutzt werden.
3) Die Klassifikation des vorliegenden Schmerzmechanismus (nozizeptiv, neuropathisch, gemischt) ist wichtig für die Wahl der Medikamente. Hierbei ist die WHO-Stufenleiter nach wie vor ein Hilfsmittel.
4) Die Erstellung eines Schmerzmanagementplans mit medikamentösen und nicht medikamentösen Massnahmen und
die Besprechung desselben mit den Betroffenen und ihren Angehörigen ist ein wichtiger Teil der Schmerztherapie.
5) Eine umfassende Schmerztherapie beinhaltet, wenn immer möglich und sinnvoll, eine Behandlung der Grunderkrankung (z.B. Bestrahlung von Metastasen, Parkinson-spezifische Therapie).
6) Zur Schmerzlinderung sollte ein schrittweises Vorgehen angestrebt werden, z.B. als erster Schritt eine Verbesserung der Beschwerden in der Nacht.
7) Bei unzureichender Beschwerdelinderung oder herausfordernden Situationen sollte eine spezialisierte schmerztherapeutische Expertise beigezogen werden. «Never say: There’s nothing more I can do for you» (44).
1. Definition Palliative Care der WHO: Palliative care (who.int), abgerufen 27.2.24 18:00
2. Christian Volberg, Hinnerk Wulf, Ann-Kristin Schubert, 2023, Pain Management in Palliative Care, AINS/ Anästhesiol Intensivmed Notfallmed Schmerzther, 58(02): 95-110
3. SolanoJ, Gomes B, Higginson IJ (2006). A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease. Journal of Pain and Symptom Management. 31: 58 -69
4. Fallon M, Giust R, Aielli F et al (2018). Management of cancer pain in adult patients: ESMO clinical practice guidelines. Annals of Oncology 29(Suppl4) iv166-191
5. S3-Leitlinie Palliativmedizin (awmf.org), abgerufen 13.03.24 21:00
6. Friedemann Nauck, Integration der Palliativmedizin in der Akutmedizin: MedKlin Intensivmed Notfmed 2021; 116(3): 267-276
7. Prof. Dr. V. Mylius et al., Die neue Parkinson-Schmerzklassifikation (PSK), 10/2022, Der Nervenarzt, 93:1019–1027
8. Daniel Schick et al., Palliativversorgung bei Herzinsuffizienz, Zeitschrift für Palliativmedizin 2022; 23(06): 327-344
9. Bennett MI, Eisenberg E, Ahmedzai SH et al (2019). Standards for the management of cancer‐related pain across Europe – A position paper from the EFIC Task Force on CancerPain. Eur J Pain 23: 660-668
10. Was ist Schmerz (schmerzgesellschaft.de), abgerufen 27.2.24 18:27
11. Lorenz Fischer, Elmar T. Peuker, Lehrbuch Integrative Schmerztherapie, Karl F. Haug Verlag, 2011
12. Nozizeptoren – Lexikon der Biologie (spektrum.de), abgerufen 10.3.24 20:15
13. Durchbruchschmerz: Link: Thieme E-Journals – Arzneimittelforschung / Abstract (thieme-connect.de),abgerufen 27.2.24 18:00
14. Bundesamt für Gesundheit BAG und Schweizerische Konferenz der kantonalen Gesundheitsdirektorinnen und -direktoren GDK (2011): Nationale Leitlinien Palliative Care. Aktualisierte Version 2014
15. Engel, G. L., Adler, R., Grögler, A. (2011). Schmerz umfassend verstehen: der biopsychosoziale Ansatz zeigt den Weg. Schweiz: Huber.
16. Frick, Eckhard and Anneser, Johanna. „Total Pain“ Spiritual Care, vol. 6, no. 3, 2017, pp. 349-350. https://doi.org/10.1515/spircare-2016-0194
17. Saunders C. The evolution of palliative care. J R Soc Med. 2001 Sep;94(9):430-2.
18. Ong CK, Forbes D. Embracing Cicely Saunders‘s concept of total pain. BMJ. 2005 Sep 10;331(7516):576.31(7516):576.
19. Laufenberg-Feldmann R, Schwab R, Rolke R, Weber M. Tumorschmerz in der Palliativmedizin. Internist (Berl). 2012 Feb;53(2):177-90.
20. Eychmüller S. Palliativmedizin Essentiels. Das 1 x 1 der Palliative Care. Hochgrefe Verlag. 2.Ausgabe
21. Caraceni A, Cherny N, Fainsinger R et al. Pain measurement tools and methods in clinical research in palliative care: recommendations of an expert working group of the European Association of Palliative Care. J Pain Symptom Manage. 2002; 23: 239–255.
22. Lautenbacher S; Kunz M. Schmerzerfassung bei Patienten mit Demenz. (2019). Der Schmerz 33: 563 – 575
23. Manna A, Sarkar SK, Khanra LK. PA1 An internal audit into the adequacy of pain assessment in a hospice setting. BMJ Support Palliat Care. 2015 Apr;5 Suppl 1:A19-20.
24. Twycross R. and Wilcock A. Introducing palliative care. Pharmaceutical Press; 5th edition
25. Van Veen S, Drenth H, Hobbelen H et al. (2024). Non-pharamacological interventions feasible in the nursing scope for pain relief in palliative care patients: a systematic rewview. Palliatve Care & Social Practice 18: 1 – 23
26. Hurlow A, Bennett MI, Robb KA, Johnson MI, Simpson KH, Oxberry SG. Transcutaneous electric nerve stimulation (TENS) for cancer pain in adults. Cochrane Database Syst Rev. 2012 Mar 14;2012(3):CD006276.
27. Liampas A, Rekatsina M, Vadalouca A, Paladini A, Varrassi G, Zis P. Non-Pharmacological Management of Painful Peripheral Neuropathies: A Systematic Review. Adv Ther. 2020 Oct;37(10):4096-4106.
28. https://apps.who.int/iris/bitstream/handle/10665/279700/9789241550390-eng.pdf
29. Twycross R., Wilcock A., Howard P. Palliative Care Formulary,(PCF 6). Pharmaceutical Press; 6th edition
30. Steins MB, Eschbach C, Villalobos M, Thomas M. Schmerztherapie in der Palliativmedizin. Pneumologie. 2017 May;71(5):297-306.
31. Wood H, Dickman A, Star A, Boland JW. Updates in palliative care – overview and recent advancements in the pharmacological management of cancer pain. Clin Med (Lond). 2018 Feb;18(1):17-22.
32. Anekar AA, Hendrix JM, Cascella M. WHO Analgesic Ladder. 2023 Apr 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 32119322.
33. H.P. Rang, M.M. Dale, J.M. Ritte, R.J. Flower, G. Henderson. Rang and Dale’s Pharmacology. Churchill Livingstone. 7th Edition.
34. Wiffen PJ, Derry S, Moore RA, McNicol ED, Bell RF, Carr DB, McIntyre M, Wee B. Oral paracetamol (acetaminophen) for cancer pain. Cochrane Database Syst Rev. 2017 Jul 12;7(7):CD012637.
35. Rémi C, Bausewein C, Wilcock A et al. (2022). Arzneimitteltherapie in der Palliativmedizin. Elesevier GmbH. 4. Auflage
36. Gaertner J, Stamer UM, Remi C, Voltz R, Bausewein C, Sabatowski R, Wirz S, Müller-Mundt G, Simon ST, Pralong A, Nauck F, Follmann M, Radbruch L, Meissner W. Metamizole/dipyrone for the relief of cancer pain: A systematic review and evidence-based recommendations for clinical practice. Palliat Med. 2017 Jan;31(1):26-34.
37. Lutz M. Metamizole (Dipyrone) and the Liver: A Review of the Literature. J Clin Pharmacol. 2019 Nov;59(11):1433-1442.
38. https://www.medicines.org.uk/emc/product/7020/smpc#gref
39. https://www.medicines.org.uk/emc/product/2660/smpc#gref
40. Siegenthaler A, Eychmüller S; Pfander G, Streitberger K. Sinn und Unsinn der WHO-Stufen bei der Behandlung von Tumorschmerzen. Schweiz Med Forum 2014; 14(36): 654-658.
41. https://www.ema.europa.eu/en/documents/referral/metamizole-article-31-referral-chmp-assessment-rep.o.rt_en.pdf
42. https://www.ema.europa.eu/en/documents/product-information/glivec-epar-product-information_en.pdf
43. Martindale, The complete drug reference. Pharmaceutical Press. 35th Edition.
44. TwycrossR., Wilcock A, Stark Toller C. Introducing Palliative Care. Pharmaceutical Press. 6th Edition.
45. Liechti ME. Pharmakologie von Schmerzmitteln für die Praxis – Teil 2: Opioide. Schweiz Med Forum 2014;14(24):460–464
46. Paice JA, Bohlke K, Barton D, et al. Use of Opioids for Adults With Pain From Cancer or Cancer Treatment: ASCO Guideline. J Clin Oncol. 2023 Feb 1;41(4):914-930. doi: 10.1200/JCO.22.02198. Epub 2022 De
47. Palliative care for adults: strong opioids for pain relief. London: National Institute for Health and Care Excellence (UK); 2016 Aug. PMID: 32208569.
48. http://www.anaesthesie.usz.ch/fachwissen/Seiten/Opimeter.aspx
49. Murnion. Neuropathic pain: current definition and review of drug treatment. Aust Prescr , VOLUME 41 : NUMBER 3 : JUNE 2018
50. Smith EM, Pang H, Cirrincione C, Fleishman S, Paskett ED, Ahles T, Bressler LR, Fadul CE, Knox C, Le-Lindqwister N, Gilman PB, Shapiro CL; Alliance for Clinical Trials in Oncology. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial. JAMA. 2013 Apr 3;309(13):1359-67.
51. https://www.ema.europa.eu/en/documents/product-information/cymbalta-epar-product-information_en.pdf
52. Dean L. Amitriptyline Therapy and CYP2D6and CYP2C19 Genotype. 2017 Mar 23. In: Pratt VM, Scott SA, Pirmohamed M, Esquivel B, Kane MS, Kattman BL, Malheiro AJ, editors. Medical Genetics Summaries [Internet]. Bethesda (MD): National Center for Biotechnology Information (US); 2012–. PMID: 28520380.
53. Brunton L., Lazo J., Parker K. Goodman & Gilman’s The Pharmacological Basis of Therapeutics. 11th Edition. McGraw-Hill
54. https://www.ema.europa.eu/en/documents/product-information/lyrica-epar-product-information_en.pdf
55. https://www.ema.europa.eu/en/documents/referral/neurontin-article-30-referral-annex-i-ii-iii_en.pdf
56. Rasche T, Emmert D, Radbruch L, Conrad R, Mücke M. Cannabis und Cannabinoide in der Palliativversorgung. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2019 Jul;62(7):830-835.
57. Agar M. Medicinal cannabinoids in palliative care. Br J Clin Pharmacol. 2018 Nov;84(11):2491-2494.
58. Tanguy-Goarin C, Cogulet V. Administration des médicaments par voie sous-cutanée en soins palliatifs [Drugs administration by subcutaneous injection within palliative care]. Therapie. 2010 Nov-Dec;65(6):525-31. French
59. Jensen JJ, Sjøgren P. Administration of label and off-label drugs by the subcutaneous route in palliative care: an observational cohort study. BMJ Supp.o.rt Palliat Care. 2020 Sep 4:bmjspcare-2020-002185.
60. Bartz L, Klein C, Seifert A, Herget I, Ostgathe C, Stiel S. Subcutaneous administration of drugs in palliative care: results of a systematic observational study. J Pain Symptom Manage. 2014 Oct;48(4):540-7.
61. Broadhurst D, Cooke M, Sriram D, Gray B. Subcutaneous hydration and medications infusions (effectiveness, safety, acceptability): A systematic review of systematic reviews. PLoS One. 2020 Aug 24;15(8)
62. AWMF-Registernummer 032/054OL, https://www.leitlinienprogrammonkologie.de/leitlinien/supp.o.rtive-therapie/ (Zugriff am 14.03.2024)
63. Vierhig et al. SOP-Schmerztherapie bei Palliativpatienten; Onkologe 2018; 24
64. Lehrbuch Integrative Schmerztherapie, Thieme 2011, S. 588
65. Lehrbuch I care Pflege, Thieme Verlag 2020, Graphik Total Pain: 41.Pflege des sterbenden Menschen – Pflegepädagogik – Georg Thieme Verlag, abgerufen 10.3.24 19:00
Therapeutische Umschau
- Vol. 81
- Ausgabe 4
- August 2024