- Vaskuläre Dyspnoe: Lungenembolie
Eine 83-jährige Frau mit bekannter koronarer Herzkrankheit und milder chronischer Herzinsuffizienz stellt sich notfallmässig bei Ihnen in der Praxis vor. Sie berichtet über plötzlich aufgetretene Atemnot und stechende Thoraxschmerzen während den letzten Stunden. Sie ist afebril, der Blutdruck beträgt 135/90 mmHg, der Puls ist unregelmässig und tachykard (125/min). Die Atemfrequenz liegt bei 30/min, das Pulsoxymeter zeigt 88% unter Raumluft. Bei der körperlichen Untersuchung fallen leicht geschwollene Unterschenkel beidseits auf, die Jugularvenen sind nicht gestaut, die Lungenauskultation ist unauffällig. Ein EKG zeigt ein Vorhofflimmern ohne Repolarisationsstörungen. Im Praxislabor sind das hochsensitive Troponin leicht (35ng/l), die D-Dimere deutlich (1.0mg/L) erhöht. Sie weisen die Patientin mit Verdacht auf eine Lungenembolie zur CT-Angiographie auf die Notfallstation des nächsten Spitals ein.
Einleitung
Bei älteren, multimorbiden Patient*Innen gehört die akute Dyspnoe zu den häufigsten Symptomen, die zu notfallmässigen Konsultationen und Hospitalisationen führen (1). Die Differentialdiagnose ist breit. Das Auftreten einer Lungenarterienembolie (LE) ist dabei eine häufige Ursache. Ihre Prävalenz nimmt mit dem Alter zu. Klinisch überlappen Risikofaktoren, pathophysiologische Mechanismen und Symptomatik mit anderen kardiovaskulären Erkrankungen (z.B. Herzinsuffizienz). Diagnose und Abgrenzung gegenüber anderen Entitäten bleiben damit häufig schwierig.
Im Folgenden gehen wir auf die pathophysiologischen Mechanismen und klinische Engramme ein, die an eine LE denken lassen, skizzieren unseren Diagnosealgorithmus und schlagen auf der Grundlage der neuesten Empfehlungen einen therapeutischen Ansatz für Patienten mit einer LE vor (2-4).
Risikoprofil
Arterielle Hypertonie, Dyslipidämie, Diabetes, Adipositas, Tabakkonsum, ungesunde Ernährung, Stress, Schlafmangel und Östrogentherapie wirken sich negativ auf die Endothelfunktion aus, befördern Inflammation und Hyperkoagulabilität und begünstigen damit das Auftreten von Atherothrombosen (die in der Folge zu Myokardinfarkt und Herzinsuffizienz führen können) aber auch von venösen Thromboembolien (5). Entsprechend weisen Patienten mit koronarer Herzkrankheit oder Herzinsuffizienz auch ein deutlich erhöhtes Risiko auf, eine LE zu erleiden (6). Ob auch ein Vorhofflimmern das Risiko für eine Lungenembolie erhöht, bleibt umstritten (7, 8). Die Prävalenz von Thromben im rechten Vorhof, die konsekutiv eine ein thromboembolisches Ereignis verursachen können, wurde bei Patienten mit Vorhofflimmern als gering (<1 %) beschrieben, ganz im Unterschied zu Thromben im linken Vorhof (9 %). Während sich verschiedene kardiovaskuläre Risikofaktoren zu einem gemeinsamen Profil für kardiale Erkrankungen und venöse Thromboembolien ergänzen, stellen wir dies beim Vorhofflimmern deshalb in Frage (9).
Pathophysiologie und Hämodynamik
Ein Gerinnsel in der Lungenstrombahn kann zu einem prompten Anstieg des pulmonalen Druckes führen und damit eine rechtsventrikuläre Dysfunktion – «akutes Cor pulmonale» – verursachen. Ein relevanter Anstieg des Lungendrucks wird allerdings nur beobachtet, wenn mehr als die Hälfte des Lungengefässsystems durch thrombotisches Material verlegt wird (10-12). Bei geringerer Obstruktion kompensieren die Dehnung und Rekrutierung zusätzlicher Lungenkapillaren die entsprechenden Kreislaufveränderungen. Wenn sich der thrombotische Verschluss auf mehr als 50 % der Lungengefässe erstreckt, kommt es zu einem Druckanstieg. Der unkonditionierte rechte Ventrikel (RV) kann dabei einen mittleren pulmonal-arteriellen Druck von bis zu ~40 mmHg tolerieren. Bei höheren Druckwerten kommt es zu einer Beeinträchtigung der rechtsventrikulären Funktion, in extremis zum fatalen Rechtsherzversagen. Werden selbst höhere Druckwerte hämodynamisch toleriert, kann in der Regel davon ausgegangen werden, dass bereits eine rechtsventrikuläre Adaption und damit eine vorbestehende Druckerhöhung im Lungenkreislauf vorliegt («chronisches Cor pulmonale»).
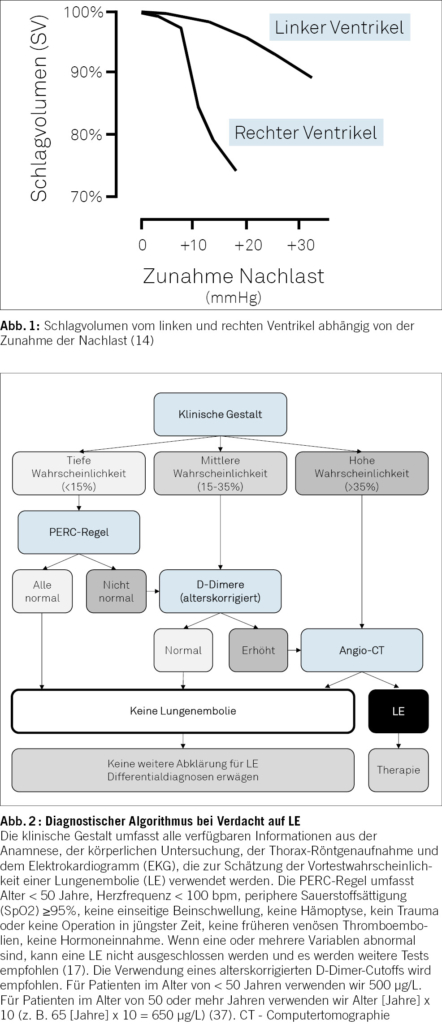
Ein – meist abrupter – Anstieg der RV-Nachlast wie er im Rahmen einer LE beobachtet wird, ist dabei der Hauptmechanismus, welcher zu einer rechtsventrikulären Dysfunktion und schlussendlich zu einem Abfall des RV-Schlagvolumens führt (Abbildung 1, adaptiert von (14)). Zudem können Alterationen der RV-Vorlast (z.B. Hypovolämie, oder – häufiger – eine systemische Stauung), der myokardialen Kontraktilität (meistens bei akuter RV-Ischämie oder bei vorbestehenden Pathologien), der ventrikulärer Interdependenz und des Herzrhythmus zu einer weiteren Verschlechterung der RV-Funktion führen (14).
Klinische Engramme & Diagnostik
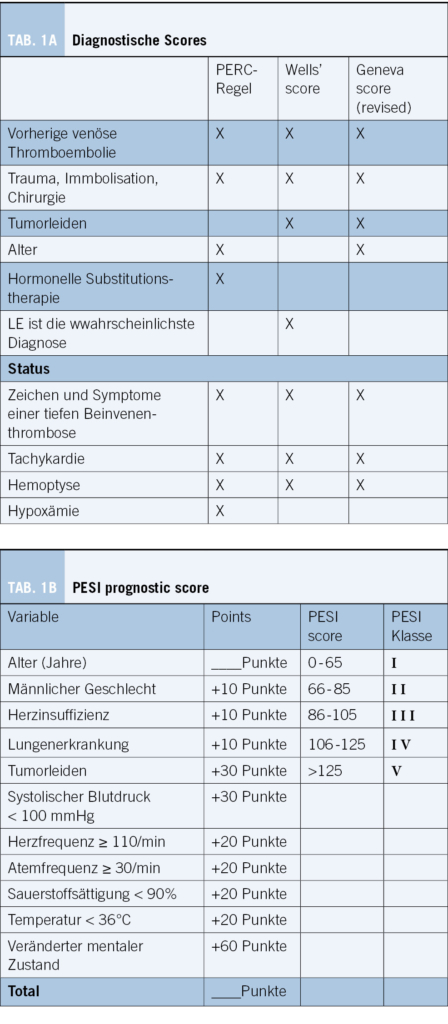
Der Diagnoseprozess zum Ausschluss einer LE umfasst Anamnese, klinische Untersuchung, die Verwendung
prädiktiver Scores, Laborparameter und eine Computertomographie der Lungengefässe (thorakales Angio-CT). Unser eigener diagnostischer Algorithmus ist in Abbildung 2 skizziert.
Vortestwahrscheinlichkeit, prädiktive Scores und D-Dimere
Jeder diagnostische Prozess beginnt mit der Formulierung einer Vortest-Wahrscheinlichkeit. Dies geschieht durch die Synthese aller zur Verfügung stehenden klinischen Informationen. Es kann dabei nicht genügend betont werden, dass das Resultat eines jeden medizinischen Tests nur im Kontext der Vortest-Wahrscheinlichkeit beurteilt werden kann.
Für die semiquantitative Einschätzung der Vortest-Wahrscheinlichkeit bei Patienten mit Verdacht auf eine LE wurden mehrere Scores entwickelt, von denen der «Geneva» und der «Wells» vermutlich die bekanntesten sind (15). Diese Scores haben sich im klinischen Alltag gut etabliert – es sind durchaus hilfreiche Instrumente zur Abschätzung der Vortest-Wahrscheinlichkeit für das Vorliegen einer LE. Sie sind allerdings meistens so konzipiert, dass sie zu einer weiteren Testkaskade führen: entweder mit Bestimmung von D-Dimeren (bei geringer Vortest-Wahrscheinlichkeit) und/oder direkt durch eine Angio-CT bei mittlerer oder hoher Wahrscheinlichkeit. Auch ihre Wertigkeit sollte aber nicht überschätzt werden: die von erfahrenen Klinikern geschätzte Vortest-Wahrscheinlichkeit für das Vorliegen einer LE ist keineswegs schlechter als die mit einem Scoring-System erhobene Wahrscheinlichkeit – im Gegenteil (16, 17). Dieser Unterschied verstärkt sich vermutlich, wenn eine Begleiterkrankung – z. B. eine Herzinsuffizienz – vorliegt, für die es keine validierten Scores gibt.
Wir plädieren deshalb dafür, bei Patienten mit Verdacht auf eine LE sich primär auf die klinische Gestalt zur Schätzung der Vortest-Wahrscheinlichkeit zu verlassen. Im Falle einer niedrigen Vortest-Wahrscheinlichkeit sollte die PERC-Regel als erstes Scoring-System zur Anwendung kommen. Mit einer Sensitivität von >97 % ermöglicht die PERC-Regel den Ausschluss einer LE ohne zusätzliche Tests (18). Aufgrund zahlreicher Überschneidungen zwischen den einzelnen Scoring-Systemen (Tabelle 1) raten wir aber davon ab, nacheinander den Wells oder den Geneva Score und anschliessend die PERC-Regel anzuwenden (19).
Wenn die Vortest-Wahrscheinlichkeit für eine LE als niedrig eingeschätzt wird und ≥1 PERC-Kriterium vorliegen oder wenn die Vortest-Wahrscheinlichkeit moderat ist, sollten die D-Dimere bestimmt werden. Bei alterskorrigiert (!) erhöhten D-Dimeren oder bei einer hohen Vortest-Wahrscheinlichkeit sollte als nächstes eine Angio-CT durchgeführt werden (Abbildung 2). Eine normale PERC-Regel oder normale altersangepasste D-Dimere schliessen eine LE sicher aus (17). Aus der Perspektive des Patienten gilt es allerdings anzumerken: Mit dem Ausschluss einer LE ist noch keine Diagnose gestellt. Beim Patienten, der sich mit unklarer Dyspnoe präsentiert, kann deshalb trotz negativer Scores und normwertigen D-Dimeren eine thorakale Computertomographie sinnvoll und diagnostisch weiterführend sein (20).
Thorakale Angio-Computertomographie (Angio-CT)
Die Angio-CT der Lunge stellt heute den Goldstandard zur Diagnose einer LE (ESC-Leitlinien Klasse I). Hier möchten wir zwei Punkte hervorheben: Erstens können gemäss Bayes‘ Theorem bei hoher Vortestwahrscheinlichkeit für das Vorliegen einer LE bis zu 8% dieser Bildgebungen falsch-negative Ergebnisse liefern (21). In unserer Erfahrung ist dies insbesondere bei Patienten mit Tumor-Mikroembolien der Fall, die – im Gegensatz zu paraneoplastischen venösen Thromboembolien – zu klein sind, um mit bildgebenden Verfahren sicher erkannt zu werden.
Zweitens kommt es bei Patienten mit akuter LE und konsekutiv systemischer venöser Stauung häufig zu einer Verschlechterung der Nierenfunktion. Tatsächlich ist die venöse Stauung, mehr noch als ein vermindertes Herzzeitvolumen, der stärkste hämodynamische Prädiktor für eine verminderte glomeruläre Filtrationsrate (22, 23). Mit der Normalisierung von Druck und Volämie (ggf. kurzfristig unterstützt durch die vorlastsenkende Wirkung von Schleifendiuretika) wird sich die Nierenfunktion in den meisten Fällen prompt wieder auf die vorbekannten Werte erholen.
Generell wird auch das Risiko einer kontrastmittelinduzierten akuten Nierenschädigung überschätzt (24). Die akute kontrastmittelinduzierte Nephropathie ist definiert als die iatrogene Verschlechterung der Nierenfunktion nach der Verabreichung von intravenösem Radiokontrastmittel – sie zeigt in der Regel einen milden Verlauf mit spontaner Rückkehr zum Ausgangswert der Nierenfunktion ohne langfristige Beeinträchtigung. Bei Patienten mit einer mittleren bis hohen Wahrscheinlichkeit für eine LE sollte wenn immer möglich eine Angio-CT als wichtiger diagnostischer Eckpfeiler durchgeführt werden.
Risikostratifizierung: Die Rolle von kardialen Biomarkern und Echokardiographie
Die Leitlinie des American College of Chest Physicians empfiehlt einen pragmatischen Ansatz zum Einsatz von Echokardiographie und kardialen Biomarkern: Auf einen routinemässigen Einsatz bei allen Patienten mit LE insbesondere sollte verzichtet werden (25). Kardiale Biomarker (u.a. hochsensitives Troponin, natriuretische Peptide) sind zwar mit einem höheren Risiko für eine LE-bedingte Mortalität assoziiert. Da sie aber in mehr als der Hälfte aller LE-Patienten erhöht sind, haben sie einen sehr geringen positiven Prädiktionswert. In der Regel beeinflussen sie die Behandlungsentscheidungen nicht (3).
Auch eine routinemässige Echokardiographie zur Beurteilung der rechtsventrikulären Funktion wird für die diagnostische Abklärung von hämodynamisch stabilen Patienten mit LE nicht empfohlen (3). Tatsächlich ist der echokardiograische Nachweis einer RV-Dysfunktion mit einer Prävalenz von gut einem Viertel der LE-Patienten häufig und mit einem schlechteren Outcome assoziiert. Vergleichbar mit den Biomarkern ist der positive Prädiktivwert für einen LE-bedingten Tod allerdings gering (26, 27).
Bei Patienten mit LE und hämodynamischer Instabilität sollte hingegen sofort eine Echokardiographie durchgeführt werden (ESC-Leitlinien Indikation Klasse I). Bei instabilen Patienten mit Verdacht auf Lungenembolie kann das Vorhandensein oder Fehlen von echokardiographischen Anzeichen eines akuten RV-Dysfunktion die Lungenembolie als Ursache der hämodynamischen Instabilität ausschliessen bzw. bestätigen und den Diagnoseprozess und die Behandlung beschleunigen (3).
Behandlung
Das Erkrankungsspektrum kann von oligo-/asymptomatischen Präsentationen bis hin zu kritischen Zuständen mit schwerer kardio-pulmonaler Instabilität reichen. Daher sollten die ersten Minuten der Triage gewidmet sein, d. h. der Beurteilung der kardio-pulmonalen Stabilität primär basierend auf Vitalparameter (Blutdruck, Herzfrequenz, Atemfrequenz, periphere Sauerstoffsättigung), der Einschätzung des Perfusionsstatus (d. h. Suche nach Zeichen einer peripheren Minderperfusion wie kalte Extremitäten, veränderte Vigilanz, Oligurie) und der Bestimmung des PESI (Pulmonal Embolism Severity Index) (2, 3). Herzstillstand, Schock (d. h. systolischer Blutdruck < 90 mmHg und Zeichen einer peripheren Minderperfusion) und anhaltende Hypotonie (systolischer Blutdruck < 90 mmHg oder die Notwendigkeit von Vasopressoren) definieren eine hämodynamische Instabilität (28). Diese Patienten benötigen eine unverzügliche Diagnostik und Therapieeinleitung. Sie sollten im Schockraum oder auf einer Intensivstation bzw. ähnlichen Einheiten mit der dafür notwendigen Infrastruktur, Personal und Expertise behandelt werden.
Die Behandlung beinhaltet Massnahmen zur hämodynamischen Stabilisierung (Vasopressoren, Inotropika, mechanische Kreislaufunterstützungssysteme) und Reperfusionsstrategien (Antikoagulation mit oder ohne systemische Fibrinolyse) abhängig vom klinischen Bild. Chirurgische oder kathetergestützte Reperfusionsstrategien können in einzelnen Fällen in Betracht gezogen werden. Detaillierte Empfehlung für die Behandlung von Patienten mit LE und hämodynamischer Instabilität finden sich in den Guidelines und im Positionspapier der European Society of Cardiology (2, 3)
Niedrigrisiko-Patienten mit kardiopulmonaler Stabilität und PESI I-II können in der normalen Notfallstation. ambulant bzw. auf der Normalstation behandelt werden. Die Oxygenierung sollte optimiert werden, indem zusätzlicher Sauerstoff über eine Nasenbrille oder eine Gesichtsmaske verabreicht wird (Ziel-SpO2 >94 %). Zusätzlicher Sauerstoff lindert nicht nur die Symptome, sondern reduziert auch die präkapillare pulmonale Vasokonstriktion und die RV-Nachlast. Umgekehrt sollte eine nicht-invasive Überdruckbeatmung mit Vorsicht eingesetzt werden, um negative Auswirkungen auf den RV zu vermeiden. Eine pulmonale oder systemische Stauung sollte mit Schleifendiuretika behandelt werden. Prompt sollte eine Antikoagulation eingeleitet werden, sobald die Diagnose einer LE sicher gestellt bzw. mit hoher Wahrscheinlichkeit vermutet wird (3). Bei den meisten stabilen Patienten kann direkt eine orale Antikoagulation mit non-Vitamin-K-oralen Antikoagulantien (NOAC) eingesetzt werden. Wenn die orale Bioverfügbarkeit der NOAC ungewiss ist (z.B. Nüchternheit, gastrointestinale Stauung, gestörte Vigilanz) oder wenn eine Steuerbarkeit der Antikoagulation erwünscht ist (z.B. bevorstehende Eingriffe, Blutungskomplikationen, dynamische Nierenfunktion) oder eine Langzeit-Antikoagulation mit Vitamin-K-Antagonisten (VKA) vorgesehen ist, beginnen wir mit einem Bolus unfraktioniertem Heparin (z.B. 80 E/kg), gefolgt von einer Dauerinfusion (z.B. 18 E/kg/h titriert nach anti-Faktor Xa) mit Wechsel auf NOAC oder (VKA) nach einigen Tagen. In diesem Rahmen möchten wir zwei Punkte im Zusammenhang mit einer NOAC-Therapie bei LE betonen, die sich vom NOAC-Einsatz bei Vorhofflimmern unterscheiden: Erstens, Rivaroxaban und Apixaban können bereits ab Diagnosestellung einer LE eingesetzt werden (beide jedoch in erhöhter Dosierung, d.h. Rivaroxaban 2×15 mg für 3 Wochen oder Apixaban 2×10 mg für 7 Tagen) während Edoxaban und Dabigatran erst nach einer mindest 5-tägiger Therapie mit Heparin eingesetzt werden können. Zweitens, die Kriterien für die Dosisreduktion der NOAC, die bei Patienten mit Vorhofflimmern angewendet werden (z.B. Alter, Gewicht, Niereninsuffizienz), sollen im Kontext einer LE-Behandlung nicht angewendet werden, mit Ausnahme von Edoxaban. Das bedeutet, dass die empfohlene Erhaltungsdosis nach den ersten Tagen (siehe oben) für Rivaroxaban 1×20 mg, für Apixaban 2×5 mg und für Dabigatran 2×150 mg, unabhängig ist von klinischen Faktoren wie Nierenfunktion. Die Kriterien für Dosisreduktion gelten jedoch für Edoxaban (volle Dosis von 1×60 mg, Redukation auf 1×30 mg falls Kreatinin-Clearance ≤ 50 ml/min, Körpergewicht ≤60 kg oder bei gleichzeitiger Anwendung von P-Glykoprotein-Inhibitoren). Wertvolle Informationen zur NOAC-Anwendung sind in der Practical Guide der European Heart Rhythm Association zu finden (29).
Post-LE-Syndrom und Verlaufskontrollen
Die Rekanalisation der Thromben und damit die Durchgängigkeit der Lungenstrombahn erfolgt bei der Mehrzahl der LE-Patienten innerhalb der ersten Wochen bis wenigen Monate (30, 31). Allerdings berichten die Patienten häufig über anhaltende Dyspnoe oder eine schlechte körperliche Leistungsfähigkeit Monate bis Jahre nach der akuten LE (32). Die funktionellen Beeinträchtigungen korrelieren häufig nicht mit der Echokardiographie oder Lungenfunktionstest, die in der Regel beide innerhalb normaler Grenzen liegen (32). Psychometrische Daten zur Lebensqualität konnten aber zeigen, dass doch immerhin 10% der Patienten im ersten Jahr nach einer LE über eine Zustandsverschlechterung klagen. Zum Risikophänotyp für die Entwicklung dieser Post-LE-Symptomatik gehören u.a. weibliches Geschlecht, Alter, eine vorbestehende kardiopulmonale Erkrankung, thromboembolisches Rezidiv und Adipositas. Insgesamt bleibt aber dieses Post-LE-Syndrom eine schlecht definierte Entität (33).
Bevor die Diagnose eines Post-LE-Syndromes gestellt werden kann, muss das Vorliegen einer chronisch-thromboembolischen pulmonalen Hypertonie (CTEPH) ausgeschlossen werden: Bei einigen wenigen LE-Patienten persistieren und organisieren sich die Thromben und führen zu Gefässumbau und einer chronischen pulmonalen Drucksteigerung (3). Eine detaillierte Erörterung von Diagnose und Behandlung der CTPEH würde den Rahmen dieses Artikels sprengen. Wir möchten jedoch betonen, dass die Diagnose einer CTEPH schwierig und die Dunkelziffer vermutlich nach wie vor hoch ist. Von einem systematischen echokardiographischen Screening bei allen Patienten nach stattgehabter LE raten wir ab, bei fehlender Symptomatik ist sie sinnlos. Bei Patienten mit einer persistierenden Symptomatik trotz einer konsequent durchgeführten Antikoagulationstherapie ≥3 Monate müssen echokardiographisch auf Zeichen einer pulmonalen Hypertonie untersucht werden. Bestätigt sich diese Drucksteigerung, sind weiterführende Tests mittels Rechtsherzkatheter und/oder Lungenszintigraphie angezeigt.
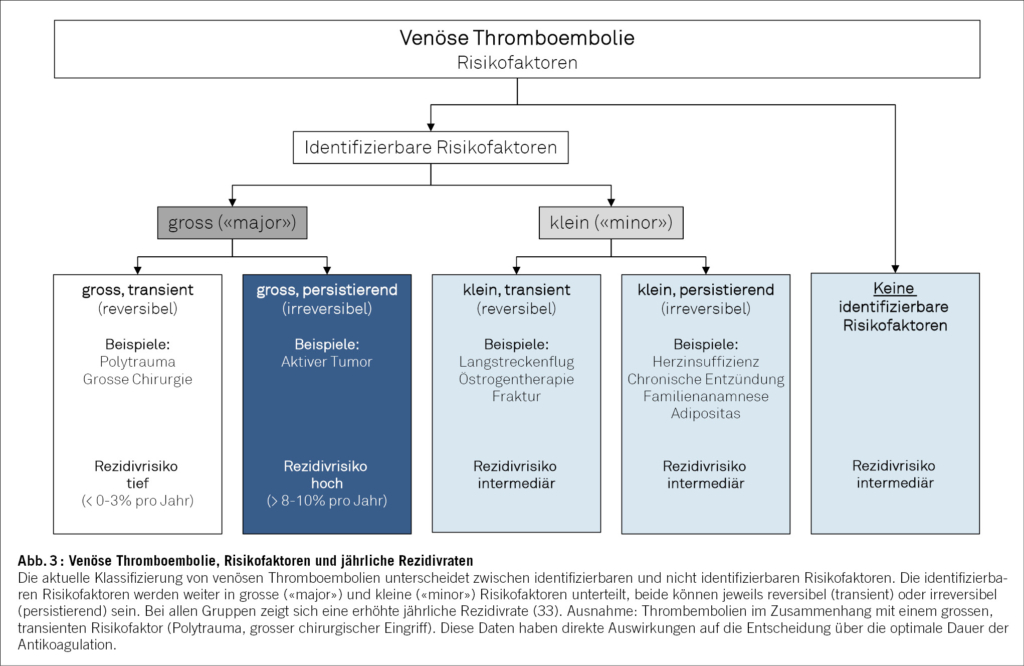
Die Dauer der Antikoagulation sollte nach Berücksichtigung der Risikofaktoren für ein Rezidiv einer venösen Thromboembolie (VTE) festgelegt werden (Abbildung 3). Die frühere Klassifizierung mit Begriffen wie «provoziert», «unprovoziert» oder «idiopathisch» sollte nicht mehr verwendet werden, sie haben sich als wenig hilfreich für die Wahl und Dauer der Antikoagulationsbehandlung erwiesen. Mit Ausnahme einer VTE, die im Zusammenhang mit einem grösseren operativen Eingriff auftritt, besteht für alle anderen Kategorien ein erhöhtes Rezidivrisiko (34). Diese Zahlen untermauern ein gemeinsames pathophysiologisches Konzept bei welchem einzelne Risikofaktoren eine thrombophile Diathese demaskieren anstatt sie zu erklären. Ferner ist zu betonen, dass die Risikokurve für Rezidive über die Zeit nicht abflacht. Die kumulative Inzidenz von Rezidiven steigt damit kontinuierlich. Ein substantieller Teil dieser rezidivierenden Ereignisse hat einen fatalen Ausgang und führt zum Tod. In Anbetracht dieser Überlegungen wird eine Antikoagulation für mindestens drei Monate bei allen Patienten mit LE empfohlen (3). Bei guter Verträglichkeit empfehlen wir dann anhand der oben erwähnten Risikogruppen in vielen Fällen eine Fortsetzung der Therapie ohne definiertes Stoppdatum (3).
Eine Gerinnungsabklärung ist nur selten angezeigt, in den Augen gewisser Expert*Innen nie. Derart apodiktisch möchten wir uns nicht äussern. Allerdings wirft eine Gerinnungsanalyse nach stattgehabter venöser Thromboembolie grundsätzliche Fragen auf: Bei Patienten mit thrombophiler Diathese ist nämlich das Risiko für ein Erstereignis erhöht, aber – verglichen mit Patienten ohne Thrombophilie – praktisch identisch für ein Rezidivereignis. Eine Gerinnungsabklärung nach stattgehabter Thromboembolie ändert damit – unabhängig vom Resultat – am weiteren therapeutischen Management nichts. Allenfalls hat eine Gerinnungsabklärung bei jüngeren, erstgradigen Verwandten von Patienten mit VTE eine Konsequenz, wobei die hohe Rate sowohl an falsch positiven als auch falsch negativen Resultaten den Nutzen für therapeutische Konsequenzen weitgehend wettmachen. Die genetischen Gerinnungsstörungen mit der höchsten Prävalenz (Faktor V Leiden und Prothrombin-Mutation) beeinflussen das Rezidivrisiko für eine venöse Thromboembolie nicht (35). Schliesslich muss gesagt werden, dass sich die Diagnose einer hereditären Thrombophilie in der Regel mit einer genauen Anamnese und damit ohne dezidierte Gerinnungsabklärung stellen lässt (reviewed in (36)).
Auch ein breites Tumorscreening ist bei fehlenden Hinweisen aus der Anamnese und Klinik (B-Symptomatik) bzw. Labor (z.B. unklare Anämie) nicht indiziert. Wir empfehlen jedoch die Durchführung der routinemässigen Vorsorgeuntersuchungen, wobei wir diese meistens erst im Abstand von mindestens drei Monaten zum Akutereignis der Lungenembolie durchführen (Notwendigkeit einer Biopsie und kurzfristiges Pausieren der Antikoagulation).
Schlussfolgerung
Das Resultat einer jeden medizinischen Untersuchung muss unter Berücksichtigung der Vortestwahrscheinlichkeit interpretiert werden. Im Kontext von akuter Dyspnoe und Lungenembolie stehen dazu verschiedene prädiktive Scores zur Verfügung. Sie sind im Alltag hilfreich, der Einschätzung von erfahrenen Ärzt*Innen aber nicht überlegen. Der Goldstandard zum Ausschluss bzw. Bestätigung einer Lungenembolie ist die thorakale Angio-CT – sie kann auch wertvolle differentialdiagnostische Hinweise zum Vorliegen anderer Pathologien liefern. Kardiale Biomarker und Echokardiographie kommen situativ zum Einsatz; bei hämodynamisch stabilen Patienten sollten sie nicht routinemässig eingesetzt werden. Die Dauer der Antikoagulation wird anhand des Risikoprofils festgelegt. Häufig favorisieren wir dabei eine prolongierte Dauer ohne definiertes Stoppdatum gegenüber einer kürzeren, klar begrenzten Therapiedauer. Der Stellenwert von Zusatzuntersuchungen (u.a. Verlaufsechokardiographie, Thrombophilie-Testung, Tumor-Screening) ist beschränkt. Routinemässig sollte darauf verzichtet werden.
Klinik Innere Medizin
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich, Schweiz
lars.huber@stadtspital.ch
Klinik Innere Medizin
Stadtspital Zürich Triemli
Birmensdorferstrasse 497
8063 Zürich, Schweiz
mattia.arrigo@uzh.ch
1. Arrigo M, Jessup M, Mullens W, Reza N, Shah AM, Sliwa K, et al. Acute heart failure. Nature Rev Dis Primers. 2020;6(1):16.
2. Harjola VP, Mebazaa A, Celutkiene J, Bettex D, Bueno H, Chioncel O, et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology. Eur J Heart Fail. 2016;18(3):226-41.
3. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603.
4. Arrigo M, Huber LC. Pulmonary Embolism and Heart Failure: A Reappraisal. Cardiac Fail Rev. 2021;7.
5. Piazza G, Goldhaber SZ. Venous thromboembolism and atherothrombosis: an integrated approach. Circulation. 2010;121(19):2146-50.
6. Sorensen HT, Horvath-Puho E, Lash TL, Christiansen CF, Pesavento R, Pedersen L, et al. Heart disease may be a risk factor for pulmonary embolism without peripheral deep venous thrombosis. Circulation. 2011;124(13):1435-41.
7. Yetkin E, Cuglan B, Turhan H, Ozturk S, Yetkin O. Ignored Identity of Age-Dependent Increase in Pulmonary Embolism: Atrial Fibrillation. Chest. 2019;156(6):1271-2.
8. Pauley E, Orgel R, Rossi JS, Strassle PD. Response. Chest. 2019;156(6):1272-3.
9. Cresti A, Garcia-Fernandez MA, Miracapillo G, Picchi A, Cesareo F, Guerrini F, et al. Frequency and significance of right atrial appendage thrombi in patients with persistent atrial fibrillation or atrial flutter. J Am Soc Echocardiogr. 2014;27(11):1200-7.
10. McIntyre KM, Sasahara AA. The ratio of pulmonary arterial pressure to pulmonary vascular obstruction: index of preembolic cardiopulmonary status. Chest. 1977;71(6):692-7.
11. McIntyre KM, Sasahara AA. The hemodynamic response to pulmonary embolism in patients without prior cardiopulmonary disease. Am J Cardiol. 1971;28(3):288-94.
12. Alpert JS, Haynes FW, Dalen JE, Dexter L. Experimental pulmonary embolism; effect on pulmonary blood volume and vascular compliance. Circulation. 1974;49(1):152-7.
13. Arrigo M, Huber LC. Pulmonary Hypertension in Pulmonary Embolism. Am J Cardiol. 2023 Jun 13:S0002-9149(23)00335-1
14. Arrigo M, Huber LC, Winnik S, Mikulicic F, Guidetti F, Frank M, et al. Right Ventricular Failure: Pathophysiology, Diagnosis and Treatment. Card Fail Rev. 2019;5(3):140-6.
15. Stussi-Helbling M, Arrigo M, Huber LC. Pearls and Myths in the Evaluation of Patients with Suspected Acute Pulmonary Embolism. Am J Med. 2019;132(6):685-91.
16. Lucassen W, Geersing GJ, Erkens PM, Reitsma JB, Moons KG, Buller H, et al. Clinical decision rules for excluding pulmonary embolism: a meta-analysis. Ann Intern Med. 2011;155(7):448-60.
17. Penaloza A, Verschuren F, Meyer G, Quentin-Georget S, Soulie C, Thys F, et al. Comparison of the unstructured clinician gestalt, the wells score, and the revised Geneva score to estimate pretest probability for suspected pulmonary embolism. Ann Emerg Med. 2013;62(2):117-24 e2.
18. Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, et al. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Thromb Haemost. 2008;6(5):772-80.
19. Theunissen J, Scholing C, van Hasselt WE, van der Maten J, Ter Avest E. A retrospective analysis of the combined use of PERC rule and Wells score to exclude pulmonary embolism in the Emergency Department. Emerg Med J. 2016;33(10):696-701.
20. Levi M, van Es N. Diagnostic Strategies for Suspected Pulmonary Embolism. JAMA. 2021;326(21):2135-6.
21. Belzile D, Jacquet S, Bertoletti L, Lacasse Y, Lambert C, Lega JC, et al. Outcomes following a negative computed tomography pulmonary angiography according to pulmonary embolism prevalence: a meta-analysis of the management outcome studies. J Thromb Haemost. 2018;16(6):1107-20.
22. Ishihara S, Gayat E, Sato N, Arrigo M, Laribi S, Legrand M, et al. Similar hemodynamic decongestion with vasodilators and inotropes: systematic review, meta-analysis, and meta-regression of 35 studies on acute heart failure. Clin Res Cardiol. 2016;105(12):971-80.
23. Mullens W, Abrahams Z, Francis GS, Sokos G, Taylor DO, Starling RC, et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol. 2009;53(7):589-96.
24. Timal RJ, Kooiman J, Sijpkens YWJ, de Vries JPM, Verberk-Jonkers I, Brulez HFH, et al. Effect of No Prehydration vs Sodium Bicarbonate Prehydration Prior to Contrast-Enhanced Computed Tomography in the Prevention of Postcontrast Acute Kidney Injury in Adults With Chronic Kidney Disease: The Kompas Randomized Clinical Trial. JAMA Intern Med. 2020;180(4):533-41.
25. Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report. Chest. 2016;149(2):315-52.
26. Coutance G, Cauderlier E, Ehtisham J, Hamon M, Hamon M. The prognostic value of markers of right ventricular dysfunction in pulmonary embolism: a meta-analysis. Crit Care. 2011;15(2):R103.
27. Arrigo M, Huber LC. Right ventricle assessment in patients with pulmonary embolism: low risk = low yield for systematic echocardiography. Eur Heart J. 2021;43(1):84-5.
28. Chioncel O, Parissis J, Mebazaa A, Thiele H, Desch S, Bauersachs J, et al. Epidemiology, pathophysiology and contemporary management of cardiogenic shock – a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22(8):1315-41.
29. Steffel J, Collins R, Antz M, Cornu P, Desteghe L, Haeusler KG, et al. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace. 2021;23(10):1612-76.
30. Dalen JE, Banas JS, Jr., Brooks HL, Evans GL, Paraskos JA, Dexter L. Resolution rate of acute pulmonary embolism in man. N Engl J Med. 1969;280(22):1194-9.
31. Tow DE, Wagner HN, Jr. Recovery of pulmonary arterial blood flow in patients with pulmonary embolism. N Engl J Med. 1967;276(19):1053-9.
32. Klok FA, van der Hulle T, den Exter PL, Lankeit M, Huisman MV, Konstantinides S. The post-PE syndrome: a new concept for chronic complications of pulmonary embolism. Blood Rev. 2014;28(6):221-6.
33. Valerio L, Barco S, Jankowski M, Rosenkranz S, Lankeit M, Held M, et al. Quality of Life 3 and 12 Months Following Acute Pulmonary Embolism: Analysis From a Prospective Multicenter Cohort Study. Chest. 2021;159(6):2428-38.
34. Prins MH, Lensing AWA, Prandoni P, Wells PS, Verhamme P, Beyer-Westendorf J, et al. Risk of recurrent venous thromboembolism according to baseline risk factor profiles. Blood Adv. 2018;2(7):788-96.
35. Christiansen SC, Cannegieter SC, Koster T, Vandenbroucke JP, Rosendaal FR. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA. 2005;293(19):2352-61.
36. Connors JM. Thrombophilia Testing and Venous Thrombosis. N Engl J Med. 2017;377(12):1177-87.
37. Righini M, Van Es J, Den Exter PL, Roy PM, Verschuren F, Ghuysen A, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA. 2014;311(11):1117-24.
Therapeutische Umschau
- Vol. 80
- Ausgabe 6
- August 2023