- Zelluläre Immuntherapien von Malignomen – Wie wirken sie und welche Nebenwirkungen sind zu erwarten
Die Immuntherapie von Krebs hat die Behandlung von onkologischen Patienten revolutioniert. Leider profitieren aber nicht alle Patienten von den aktuell zugänglichen Immuntherapien. Zelluläre Immuntherapien können hier eine neue Option bieten. Vor allem die Behandlung mit ex vivo aktivierten und expandierten Tumor-infiltrierenden Lymphozyten (TIL) hat sich bei Patienten mit immunogenen Krebsarten wie zum Beispiel dem Melanom etabliert. Zudem haben genetische Manipulationsmöglichkeiten dazu geführt, dass T Zellen mit synthetischen chimären Antigenrezeptoren (CAR) bestückt werden können, die zum Beispiel CD19-positive Krebsarten wie B-Zell-Leukämien oder auch Lymphome erkennen können. Diese zellulären Immuntherapien haben bereits Einzug in die klinische Routine gefunden und verursachen zum Teil schwere, neuartige Nebenwirkungen. In dieser Übersichtsarbeit werden die Therapien erläutert und die Nebenwirkungen, sowie deren Management beschrieben.
Einleitung
Die Krebsimmuntherapie bietet im Vergleich zu herkömmlichen Krebsbehandlungen Vorteile und hat sich in den vergangenen Jahren in vielen Bereichen der Onkologie etabliert [1, 2]. Die Immuntherapie macht sich das körpereigene Immunsystem zunutze, um Krebszellen gezielt zu erkennen und anzugreifen, während gesunde Zellen geschont werden sollen. Die Immuntherapie kann eine anhaltende Reaktion gegen Krebszellen hervorrufen und so langfristige Remissionen induzieren [3]. Sobald das Immunsystem die Krebszellen als fremd erkannt hat, kann es Gedächtniszellen entwickeln, die sich an die Antigene der Krebszellen erinnern. Diese Gedächtnisreaktion kann dazu beitragen, das Wiederauftreten von Krebs in der Zukunft zu verhindern. Die Immuntherapie hat sich als vielversprechend bei der Behandlung verschiedener Krebsarten erwiesen, darunter Melanom, Lungenkrebs, Blasenkrebs und auch bei bestimmten gastro-intestinalen Tumoren. Sie kann als alleinige Behandlung oder in Kombination mit anderen Therapien eingesetzt werden, was die Behandlungsmöglichkeiten für Patienten erweitert [1, 2]. Im Vergleich zu herkömmlichen Behandlungen wie der Chemotherapie verursacht die Immuntherapie oft weniger schwere Nebenwirkungen. Zwar können auch schwere immunbedingte Nebenwirkungen (immune-related adverse events, irAEs) auftreten, doch sind diese bei genauer Überwachung und frühzeitigem Eingreifen in der Regel gut beherrschbar [4, 5]. Neue Immuntherapien können auf die spezifische Krebsart und das Immunprofil einer Person zugeschnitten werden. Vor allem zelluläre Therapien sind hoch individualisiert. Zum Beispiel chimäre Antigenrezeptor (CAR) T Zelltherapie und die Therapie mit tumorinfiltrierenden Lymphozyten (TILs) können individuell angepasst werden, um die Wirksamkeit der Behandlung zu optimieren [6, 7].
Zelluläre Immuntherapien
Zelluläre Immuntherapien haben sich in den vergangenen Jahren stark weiterentwickelt. Neue zelluläre Therapien wurden zugelassenen, vor allem genetisch veränderte Zellen wie CAR T Zellen [6]. Die Weiterentwicklung der zellulären Immuntherapien ist aufgrund der neuen Gentechnik noch weitreichender. Die CRISPR-Cas9 und verwandte Technologien führen dazu, dass Zellen regelrecht ‘engineered’ werden können [8]. Diese Entwicklung ist sehr vielversprechend, da zum Bespiel auch Patienten mit genetischen Störungen davon profitieren können.
Genetisch unmodifizierte Zellprodukte
Zellprodukte, die nicht genetisch verändert sind, umfassen vorwiegend ex vivo aktivierte und expandierte Zellen. Hier sind vor allem TIL (tumor-infiltrierende Lymphozyten) zu nennen. Bei diesem Behandlungsansatz werden T-Zellen, die sich im Tumorgewebe befinden, kultiviert, außerhalb des Körpers vermehrt und anschließend nach einer lymphozyten-depletierenden Vorbereitungsbehandlung in denselben Patienten reinfundiert [7, 9, 10]. In zahlreichen Untersuchungen wurden die Patienten zusätzlich mit Interleukin-2 (HD IL-2) behandelt, um die erfolgreiche Integration der T-Zellen zu verbessern [7]. Diese Behandlung wurde von Steve Rosenberg am amerikanischen ‘National Institute of Health’ (NIH) entwickelt und neuste randomisierte Studien haben die Wirksamkeit von TIL-Präparaten bei Melanompatienten bewiesen [11]. Zudem wurde die Wirksamkeit auch in anderen immunogenen Tumorentitäten in nicht-randomsierten Studien nachgewiesen wie zum Beispiel beim nicht-kleinzelligen Bronchuskarzinom oder Zervixkarzinom [12, 13].
Zur Herstellung von TIL-Produkten werden aus chirurgisch entfernten Tumorstücken im Reinraum (GMP-Raum) kleine Gewebsfragmente hergestellt und die T-Zellen mit hohen Dosen mit IL-2 vermehrt. So sterben die Tumorzellen und andere Zellen (ausser die T Zellen) ab. Häufig werden die Tumorzellen auch von reaktiven T Zellen abgetötet in der Zellkultur. Die T Zellen werden dann im GMP-Raum weiter über zwei bis drei Wochen bis zu einer Anzahl von 50-100 Milliarden Zellen vermehrt mit IL-2, CD3-Stimulation und allogenen Feeder-Zellen. Wenn die Zellen im Zentrum produziert werden, in dem sie verabreicht werden, können sie frisch geerntet und frisch dem Patienten verabreicht werden. Normalerweise tritt der Patient eine Woche zuvor auf die Zelltherapie-Unit ein, damit die lympho-depletierende Chemotherapie mit Cyclophosphamid und Fludarabin eingeleitet werden kann. Mit der Verabreichung des TIL-Produktes wird zusätzlich IL-2 verabreicht [14]. Bei der Expansion und Therapie mit natürlich vorkommenden T Zellklonen geht man davon aus, dass sich tumorspezifische T-Zellen, die den Tumor mit ihrem T Zell-Rezeptor (TCR) erkennen können, sich in der Mikroumgebung der Tumorzellen befinden, diese aber aus verschiedenen Gründen nicht attackieren können (lokale Immunsuppression, Ermüdung/Exhaustion der T Zellen etc.). Durch die Kultivierung, Aktivierung und Vermehrung der T Zellen kann es aber zu einer Reaktivierung der Zellen kommen. Eine kürzlich erschienene Arbeit konnte zeigen, dass vor allem CD39 negative T Zellen, die im Körper auch länger überleben können, im TIL-Produkt helfen, längerfristig die Tumorerkrankung zu kontrollieren [15]. Zudem könnte mit der Selektion von Neoantigen-spezifischen T Zellen, die mit ihrem TCR sogenannte Neoepitope (neuentstanden, durch Mutationen bedingte Epitope) erkennen können, eine verbesserte TIL-Therapie generiert werden [10, 16]. In einer Arbeit wurde bei einem Patienten mit cholangiozellulärem Karzinom eine TIL-Therapie produziert, die spezifisch auf ein identifiziertes Neoepitop war [17]. Dies hat erfreulicherweise zu einem langfristigen Ansprechen trotz metastasierter Erkrankung geführt. Eine ähnliche erfolgreiche Anwendung von Neoantigen-selektionierten T Zellen erfolgte bei einer Patientin mit einem metastasierten, Hormonrezeptor positiven Mammakarzinom [18]. Eine Phase II Studie zeigte Ansprechen mit selektionierten T Zellen bei Patientinnen mit Brustkrebs [19]. In einer anderen Studie wurden T Zellen generiert, die p53-mutierte Neoantigen erkennen [20]. Weiter könnte die TIL-Therapie auch verbessert werden, indem die Zellen genetisch modifiziert werden [14]. Zum Beispiel können Chemokin-Rezeptoren durch virale Transduktion in die tumorspezifischen T Zellen eingebaut werden [21].
Zusammenfassend kann man sagen, dass die Phase III Studien zur Effizienz von TIL Therapien dazu führen werden, dass wir diese Therapie einer breiteren Patientenpopulation zugänglich machen müssen. Die FDA hat vor kurzem das von einer Firma hergestellte TIL-Produkt Lifileucel in den USA provisorisch zugelassen (Iovance Biotherapeutics). Auch haben die holländischen und dänischen Behörden die TIL-Therapie bei Patienten mit metastasiertem Melanom nach Versagen von Immuncheckpoint-Inhibitoren als Standardtherapie mit Kostenübernahme akzeptiert.
Genetisch modifizierte Zellen
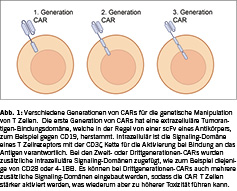
Therapien mit genetisch modifizierten Zellprodukten haben in den vergangenen Jahren Einzug in die Routinebehandlung von Patienten mit hämatologischen Neoplasien gehalten. Vor allem die mit chimären Antigenrezeptoren (CAR) bestückten T Zellen wurden erfolgreich bei Patienten mit B Zell-Neoplasien, zum Beispiel akute B Zell-Leukämien oder auch B Zell-Lymphome wie diffuse, grosszellige B-Zell-Lympome (DLBCL) angewandt (Figur 1). Die Behandlung von bösartigen B-Zell-Malignomen ist bei mehreren Indikationen zum Standard geworden, wenn die Erstbehandlung versagt hat [22-24]. Insbesondere CD19+ B-Zell-Malignome wurden erfolgreich mit CD19-spezifischen CAR T Zellen behandelt [22]. Interessanterweise konnten bei Patienten mit vielen vorangegangenen Therapielinien und refraktärer Erkrankung mit der CAR-T Zelltherapie dauerhafte Remissionen erzielt werden. In jüngster Zeit haben mehrere Studien gezeigt, dass die CAR-T-Zelltherapie auch bei Patienten mit rezidiviertem/refraktärem (r/r) diffus-großzelligem B-Zell-Lymphom (DLBCL) eine Rolle spielt, da sie in diesem Fall die autologe Stammzelltransplantation ersetzen könnte [25]. Alle drei kommerziell erhältlichen CD19-gerichteten CAR-T Zellen wurden in randomisierten Phase-III-Studien getestet. In der ZUMA-7-Studie wurde axicabtagene ciloleucel (axi-cel) im Vergleich zur Standardtherapie bei 359 Patienten getestet [26]. Die ereignisfreie 2-Jahres-Überlebensrate bei den mit axi-cel behandelten Patienten betrug 41 % gegenüber 16 % in der Gruppe mit Standardtherapie. Die Belinda-Studie umfasste 322 Patienten und verglich den Einsatz von Tisagenlecleucel (tisa-cel) mit der Standardbehandlung [27]. In dieser Studie war das ereignisfreie Überleben in beiden Gruppen ähnlich. Die Transform-Studie untersuchte den Einsatz von Lisocabtagene Maraleucel (liso-cel) bei 184 r/r DLBCL-Patienten [28]. Das ereignisfreie Überleben war in der liso-cel-Gruppe mit 10,2 Monaten gegenüber 2,3 Monaten deutlich besser. Darüber hinaus werden CD19-gerichtete CAR-T-Zellen erfolgreich bei anderen B-Zell-Lymphomen und B-Zell-Leukämien eingesetzt [22, 23]. So haben CD19-gerichtete CAR-T Zellen bei Patienten mit hochrefraktärer akuter lymphoblastischer Leukämie erfolgreich dauerhafte Remissionen bewirkt [29, 30]. Darüber hinaus wurden follikuläre Lymphome und Mantelzell-Lymphome erfolgreich mit CD19-gerichteten CAR T Zellen behandelt [31, 32].
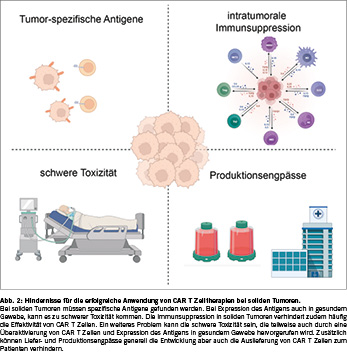
Weitere CAR T Zellbehandlungen, sind Therapien, die gegen das multiple Myelom wirken, zum Beispiel gegen das Antigen BCMA und auch gegen GPRC5D [33, 34]. Resistenz gegen die CAR-T-Zelltherapie ist weit verbreitet. So beträgt das progressionsfreie Überleben nach 5 Jahren bei Patienten mit DLBCL nur etwa 30 % und bei Patienten mit follikulärem Lymphom etwa 40 % [35]. Es wurden mehrere Mechanismen der Resistenz gegen CAR-T Zell-Therapien identifiziert (Figur 2). Ein Verständnis für diese Resistenzmechanismen kann helfen, neue CAR T Zelltherapien zu generieren. Insbesondere können so hoffentlich in Zukunft auch CAR T Zelltherapien entwickelt werden, die bei soliden Tumoren (>90% aller erwachsenen Krebspatienten) wirken. Erste CAR T Zelltherapien für Patienten mit gastro-intestinalen Tumoren zeigen bereits Erfolg [36]. Bei dieser Studie, welche bei Patienten mit fortgeschrittenem Magenkarzinom und Pankreaskarzinom durchgeführt wurde, wurden T Zellen mit einem CAR bestückt, der Claudin 18.2 erkennt.
Neue Genmodifikationsmethoden werden in Zukunft dabei helfen, ‘engineered’ Zellen herzustellen. Zum Beispiel, können Immunzellen hergestellt werden, die zwei Tumorantigene binden müssen, damit die Zelle aktiviert wird [37, 38]. So kann die Spezifität und die on-target off-tumor Toxizität deutlich erhöht werden.
Nicht-maligne Indikationen
Zelluläre Therapien können auch bei Patienten eingesetzt werden, die nicht an einer Krebserkrankung leiden [24]. Zum Beispiel können Patienten mit resistenten Infektionserkrankungen wie Virusinfekte, zum Beispiel mit dem Eb-stein-Barr Virus erfolgreich mit Virus-spezifischen T Zellen behandelt werden [39, 40]. Auch Immunerkrankungen wie zum Beispiel ein systemischer Lupus erythematodes können mit CAR Zellen behandelt werden [41]. Zudem bestehen Bestrebungen, regulatorische T Zellen genetisch zu manipulieren, um periphere Immuntoleranz zu ermöglichen, zum Beispiel bei Patienten nach Organtransplantation [6].
Nebenwirkungen
Immuntherapien haben ganz andere Nebenwirkungen als klassische onkologische Therapien wie Chemotherapien oder auch zielgerichtete Therapien. Viele der Nebenwirkungen kommen durch eine akute oder chronische Überaktivierung des Immunsystems zustande [4].
Nebenwirkungen von TIL-Therapien
Die Nebenwirkungen wurden sehr gut im Rahmen der Phase III Studie mit TIL-Therapie bei Melanompatienten dokumentiert [11]. Man muss vor allem Nebenwirkungen von der lympho-depletierenden Chemotherapie, von der TIL-Infusion sowie der IL-2 Therapie voneinander unterscheiden. Die Hauptnebenwirkungen der Cyclophosphamid und Fludarabin-Behandlung ist die Knochenmarkstoxizität und die davon herrührende Infektionsgefahr. Zudem treten auch Thrombozytopenien auf. In der Studie von Rohaan et al hatten alle Patienten, die Chemotherapie erhalten haben, eine Neutropenie Grad 3 und höher und 90% eine Thrombozytopenie [11]. Aufgrund der Knochenmarkstoxizität, welche mit dem Nadir genau in den Zeitraum der TIL-Transfusion und der IL-2 Behandlung fällt, muss häufig mit Breitbandantibiotika behandelt werden. Zudem werden eine Pneumocystis jirovecii-, sowie eine Herpesvirusprophylaxe durchgeführt. Weitere Nebenwirkungen der lympho-depletierenden Chemotherapie sind eine mögliche Zystitis durch die hohen Dosen Cyclophosphamid, sowie auch eine Hyophosphatämie.
Durch die TIL und IL-2 Therapie haben über 90% der behandelten Patienten in der Phase III Studie Fieber entwickelt [11]. Zudem kommt bei einigen Patienten ein Zytokinfreisetzungssyndrom (‘Cytokine Release Syndrome’, CRS) mit assoziierter Hypotonie und Kreislaufinstabilität vor. IL-2 kann typischerweise auch ein ‘Capillary Leak Syndrome’, das heisst eine Extravasation von Flüssigkeit bewirken. Unsere jüngste klinische Studie am Universitätsspital Basel hat Ende 2022 die Rekrutierung abgeschlossen und die geplanten 9 Patienten standen für die Sicherheitsanalyse zur Verfügung. Elf Patienten wurden eingeschlossen, 9 Patienten haben ein TIL-Produkt erhalten. Insgesamt haben wir bei allen Patienten Nebenwirkungen beobachtet, viele davon aufgrund der Chemotherapie. Bei einem Patienten, der kurz nach der Verabreichung des TIL-Produkts ein akutes Atemnotsyndrom und ein Zytokinfreisetzungssyndrom entwickelte, musste eine Verlegung auf die Intensivstation zur Vasopressoren-Therapie und zur Beatmung erfolgen.
Während der Verabreichung von TILs sollte wenn möglich auf Corticosteroide verzichtet werden, da diese die T Zellaktivität hemmen können. Sollten jedoch schwere, durch Entzündung bedingte Nebenwirkungen auftreten, sollen Corticosteroide eingesetzt werden. Da IL-6R bei CRS häufig eine Rolle spielt, sollen blockierende Antikörper wie das Tocilizumab bei höherem Schweregrad verabreicht werden. Bei Kreislaufinstabilität ist auch eine Verlegung auf eine Überwachungsstation nötig und gegebenenfalls müssen kreislaufstützende Medikamente eingesetzt werden.
Nebenwirkungen der CAR T Zelltherapie
Die CAR-T-Zelltherapie ist eine vielversprechende Behandlung für Krebs, kann aber auch verschiedene, zum Teil sehr schwerwiegende Nebenwirkungen haben. Eine der häufigsten Nebenwirkungen ist das CRS, das Fieber, niedrigen Blutdruck und Organdysfunktion verursachen kann [42, 43]. Eine weitere mögliche Nebenwirkung bei CD19-gerichteten CAR T Zelltherapien ist das Immuneffektorzell-assoziierte Neurotoxizitätssyndrom (ICANS), das Verwirrung, Krampfanfälle und andere neurologische Symptome hervorrufen kann [42, 44]. Als häufige Folge der lympho-depletierenden Chemotherapie, die auch bei der CAR T Zelltherapie eine Behandlung mit Cyclophosphamid und Fludarabin beinhaltet, können auch Infektionen auftreten, die zu schweren und potenziell lebensbedrohlichen Komplikationen führen [45]. In den grösseren, Phase III Studien in der Zweitlinientherapie von Patienten mit DLBCL haben Zweitgenerationen-CAR T Zellen bis 90% ein CRS und 60% neurologische Nebenwirkungen hervorgerufen, wobei die Nebenwirkungen zum grössten Teil nicht gravierend und reversibel waren [26].
Niedriggradige CRS werden mit supportiven Massnahmen behandelt inklusive Antipyretika und Flüssigkeitssupport [43]. Schwerere CRS werden mit IL-6R blockierenden Antikörpern und Immunsuppression mit Corticosteroiden behandelt. Gegebenenfalls müssen Patienten auch auf die Intensivstation zu Kreislaufüberwachung, Vasopressoren-
therapie und möglicherweise auch zur Sauerstofftherapie bis hin zur Beatmung. Während IL-6 Blockade beim CRS häufig eine gute Wirkung hat, nützt diese Massnahme bei Patienten mit ICANS nicht [43]. Häufig werden beim ICANS Cortikosteroide zur Behandlung neben supportiven Massnahmen angewandt.
Natürlich können mit neuem CAR-Design gegebenenfalls diese Nebenwirkungen, die teilweise lebensbedrohlich sind, reduziert werden. Es ist schon bekannt, dass CARs mit einer CD28 intrazellulären co-stimulatorischen Domäne (z.B. axi-cel) rascher proliferieren und rascher eine höhere Konzentration an Zytokinen freisetzen, sodass daraus imVergleich zu 4-1BB-haltigen CARs (z.B. tisa-cel) frühere und häufiger schwerere CRS und ICANS resultieren [46]. Direkte Vergleichsstudien in Patienten existieren aber nicht und es kann keine definitive Aussage getroffen werden, welcher CAR mehr Toxizität verursacht. Es konnte auch in ersten Studien gezeigt werden, dass Änderungen in der Signaling-Domäne der CD3 Kette eine Verbesserung des Nebenwirkungsprofils bringen könnte [47].
Fazit
Zelluläre Immuntherapien haben neue Möglichkeiten für unsere Patienten hervorgebracht. Insbesondere wird das Zell-Engineering in Zukunft eine wichtige Rolle spielen und noch deutlich verbesserte Produkte auf den Markt bringen. Die Nebenwirkungen dieser Therapien sind zum Teil neuartig, aber oft gut behandelbar und reversibel. Durch die teilweise langanhaltende Wirkung der zellulären Immuntherapien können einzelne Patienten zum Teil trotz fortgeschrittener und stark vorbehandelter Erkrankungen langfristig in Remission gebracht werden.
Departement Biomedizin
DBM Hebelstrasse – FG Läubli
Hebelstrasse 20
4031 Basel
heinz.laeubli@unibas.ch
Interessenkonflikte:
H.L. erhielt Reisekostenzuschüsse und Beraterhonorare von Bristol-Myers Squibb (BMS) und Merck, Sharp and Dohme (MSD). H.L. erhielt Forschungsunterstützung von BMS, Novartis, GlycoEra und Palleon Pharmaceuticals. H.L. ist Gründer der Glycocalyx Therapeutics AG.
1. Sharma P, Goswami S, Raychaudhuri D, Siddiqui BA, Singh P, Nagarajan A, et al. Immune checkpoint therapy-current perspectives and future directions. Cell. 2023; 186(8): 1652-69.
2. Kirchhammer N, Trefny MP, Auf der Maur P, Laubli H, Zippelius A. Combination cancer immunotherapies: Emerging treatment strategies adapted to the tumor microenvironment. Sci Transl Med. 2022; 14(670): eabo3605.
3. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, et al. Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med. 2017; 377(14): 1345-56.
4. Konig D, Laubli H. Mechanisms of Immune-Related Complications in Cancer Patients Treated with Immune Checkpoint Inhibitors. Pharmacology. 2021; 106(3-4): 123-36.
5. Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018; 378(2): 158-68.
6. Finck AV, Blanchard T, Roselle CP, Golinelli G, June CH. Engineered cellular immunotherapies in cancer and beyond. Nat Med. 2022; 28(4): 678-89.
7. June CH, Riddell SR, Schumacher TN. Adoptive cellular therapy: a race to the finish line. Sci Transl Med. 2015; 7(280): 280ps7.
8. Sadeqi Nezhad M, Yazdanifar M, Abdollahpour-Alitappeh M, Sattari A, Seifalian A, Bagheri N. Strengthening the CAR-T cell therapeutic application using CRISPR/Cas9 technology. Biotechnol Bioeng. 2021; 118(10): 3691-705.
9. Rosenberg SA, Yannelli JR, Yang JC, Topalian SL, Schwartzentruber DJ, Weber JS, et al. Treatment of patients with metastatic melanoma with autologous tumor-infiltrating lymphocytes and interleukin 2. J Natl Cancer Inst. 1994; 86(15): 1159-66.
10. Rosenberg SA, Parkhurst MR, Robbins PF. Adoptive cell transfer immunotherapy for patients with solid epithelial cancers. Cancer Cell. 2023; 41(4): 646-8.
11. Rohaan MW, Borch TH, van den Berg JH, Met O, Kessels R, Geukes Foppen MH, et al. Tumor-Infiltrating Lymphocyte Therapy or Ipilimumab in Advanced Melanoma. N Engl J Med. 2022; 387(23): 2113-25.
12. Creelan BC, Wang C, Teer JK, Toloza EM, Yao J, Kim S, et al. Tumor-infiltrating lymphocyte treatment for anti-PD-1-resistant metastatic lung cancer: a phase 1 trial. Nat Med. 2021; 27(8): 1410-8.
13. Son J, George GC, Nardo M, Krause KJ, Jazaeri AA, Biter AB, et al. Adoptive cell therapy in gynecologic cancers: A systematic review and meta-analysis. Gynecol Oncol. 2022; 165(3): 664-70.
14. van den Berg JH, Heemskerk B, van Rooij N, Gomez-Eerland R, Michels S, van Zon M, et al. Tumor infiltrating lymphocytes (TIL) therapy in metastatic melanoma: boosting of neoantigen-specific T cell reactivity and long-term follow-up. J Immunother Cancer. 2020; 8(2).
15. Krishna S, Lowery FJ, Copeland AR, Bahadiroglu E, Mukherjee R, Jia L, et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 2020; 370(6522): 1328-34.
16. Bobisse S, Genolet R, Roberti A, Tanyi JL, Racle J, Stevenson BJ, et al. Sensitive and frequent identification of high avidity neo-epitope specific CD8 (+) T cells in immunotherapy-naive ovarian cancer. Nat Commun. 2018; 9(1): 1092.
17. Tran E, Turcotte S, Gros A, Robbins PF, Lu YC, Dudley ME, et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer. Science. 2014; 344(6184): 641-5.
18. Zacharakis N, Chinnasamy H, Black M, Xu H, Lu YC, Zheng Z, et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat Med. 2018; 24(6): 724-30.
19. Zacharakis N, Huq LM, Seitter SJ, Kim SP, Gartner JJ, Sindiri S, et al. Breast Cancers Are Immunogenic: Immunologic Analyses and a Phase II Pilot Clinical Trial Using Mutation-Reactive Autologous Lymphocytes. J Clin Oncol. 2022; 40(16): 1741-54.
20. Kim SP, Vale NR, Zacharakis N, Krishna S, Yu Z, Gasmi B, et al. Adoptive Cellular Therapy with Autologous Tumor-Infiltrating Lymphocytes and T-cell Receptor-Engineered T Cells Targeting Common p53 Neoantigens in Human Solid Tumors. Cancer Immunol Res. 2022; 10(8): 932-46.
21. Forget MA, Tavera RJ, Haymaker C, Ramachandran R, Malu S, Zhang M, et al. A Novel Method to Generate and Expand Clinical-Grade, Genetically Modified, Tumor-Infiltrating Lymphocytes. Front Immunol. 2017; 8: 908.
22. Frigault MJ, Maus MV. State of the art in CAR T cell therapy for CD19+ B cell malignancies. J Clin Invest. 2020; 130(4): 1586-94.
23. van de Donk N, Usmani SZ, Yong K. CAR T-cell therapy for multiple myeloma: state of the art and prospects. Lancet Haematol. 2021; 8(6): e446-e61.
24. Labanieh L, Mackall CL. CAR immune cells: design principles, resistance and the next generation. Nature. 2023; 614(7949): 635-48.
25. Westin J, Sehn LH. CAR T cells as a second-line therapy for large B-cell lymphoma: a paradigm shift? Blood. 2022; 139(18): 2737-46.
26. Locke FL, Miklos DB, Jacobson CA, Perales MA, Kersten MJ, Oluwole OO, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 640-54.
27. Bishop MR, Dickinson M, Purtill D, Barba P, Santoro A, Hamad N, et al. Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med. 2022; 386(7): 629-39.
28. Kamdar M, Solomon SR, Arnason J, Johnston PB, Glass B, Bachanova V, et al. Lisocabtagene maraleucel versus standard of care with salvage chemotherapy followed by autologous stem cell transplantation as second-line treatment in patients with relapsed or refractory large B-cell lymphoma (TRANSFORM): results from an interim analysis of an open-label, randomised, phase 3 trial. Lancet. 2022; 399(10343): 2294-308.
29. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018; 378(5): 439-48.
30. Park JH, Riviere I, Gonen M, Wang X, Senechal B, Curran KJ, et al. Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. N Engl J Med. 2018; 378(5): 449-59.
31. Hirayama AV, Gauthier J, Hay KA, Voutsinas JM, Wu Q, Pender BS, et al. High rate of durable complete remission in follicular lymphoma after CD19 CAR-T cell immunotherapy. Blood. 2019; 134(7): 636-40.
32. Wang M, Munoz J, Goy A, Locke FL, Jacobson CA, Hill BT, et al. KTE-X19 CAR T-Cell Therapy in Relapsed or Refractory Mantle-Cell Lymphoma. N Engl J Med. 2020; 382(14): 1331-42.
33. San-Miguel J, Dhakal B, Yong K, Spencer A, Anguille S, Mateos MV, et al. Cilta-cel or Standard Care in Lenalidomide-Refractory Multiple Myeloma. N Engl J Med. 2023.
34. Mailankody S, Devlin SM, Landa J, Nath K, Diamonte C, Carstens EJ, et al. GPRC5D-Targeted CAR T Cells for Myeloma. N Engl J Med. 2022; 387(13): 1196-206.
35. Chong EA, Ruella M, Schuster SJ, Lymphoma Program Investigators at the University of P. Five-Year Outcomes for Refractory B-Cell Lymphomas with CAR T-Cell Therapy. N Engl J Med. 2021; 384(7): 673-4.
36. Qi C, Gong J, Li J, Liu D, Qin Y, Ge S, et al. Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial interim results. Nat Med. 2022; 28(6): 1189-98.
37. Zhu I, Liu R, Garcia JM, Hyrenius-Wittsten A, Piraner DI, Alavi J, et al. Modular design of synthetic receptors for programmed gene regulation in cell therapies. Cell. 2022; 185(8): 1431-43 e16.
38. Hyrenius-Wittsten A, Su Y, Park M, Garcia JM, Alavi J, Perry N, et al. SynNotch CAR circuits enhance solid tumor recognition and promote persistent antitumor activity in mouse models. Sci Transl Med. 2021; 13(591).
39. Barrett AJ, Prockop S, Bollard CM. Virus-Specific T Cells: Broadening Applicability. Biol Blood Marrow Transplant. 2018; 24(1): 13-8.
40. Walti CS, Stuehler C, Palianina D, Khanna N. Immunocompromised host section: Adoptive T-cell therapy for dsDNA viruses in allogeneic hematopoietic cell transplant recipients. Curr Opin Infect Dis. 2022; 35(4): 302-11.
41. Mougiakakos D, Kronke G, Volkl S, Kretschmann S, Aigner M, Kharboutli S, et al. CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus. N Engl J Med. 2021; 385(6): 567-9.
42. Namuduri M, Brentjens RJ. Medical management of side effects related to CAR T cell therapy in hematologic malignancies. Expert Rev Hematol. 2016; 9(6): 511-3.
43. Morris EC, Neelapu SS, Giavridis T, Sadelain M. Cytokine release syndrome and associated neurotoxicity in cancer immunotherapy. Nat Rev Immunol. 2022; 22(2): 85-96.
44. Brudno JN, Kochenderfer JN. Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management. Blood Rev. 2019; 34: 45-55.
45. Korell F, Schubert ML, Sauer T, Schmitt A, Derigs P, Weber TF, et al. Infection Complications after Lymphodepletion and Dosing of Chimeric Antigen Receptor T (CAR-T) Cell Therapy in Patients with Relapsed/Refractory Acute Lymphoblastic Leukemia or B Cell Non-Hodgkin Lymphoma. Cancers (Basel). 2021; 13(7).
46. Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017; 377(26): 2531-44.
47. Feucht J, Sun J, Eyquem J, Ho YJ, Zhao Z, Leibold J, et al. Calibration of CAR activation potential directs alternative T cell fates and therapeutic potency. Nat Med. 2019; 25(1): 82-8.
Therapeutische Umschau
- Vol. 80
- Ausgabe 8
- Oktober 2023